Современная металлургия сталкивается с необходимостью эффективного извлечения драгоценных металлов из техногенных и производственных растворов, образующихся в ходе переработки цветных металлов. Ключевую роль в таких технологиях играют экстракционные процессы, позволяющие селективно концентрировать и очищать благородные компоненты, включая платину, палладий, иридий, рутений и золото. В последние десятилетия особое внимание уделяется использованию органических сульфидов и сульфооксидов, обладающих высокой селективностью и сорбционной емкостью, а также способности регенерироваться без потери активности.
Для выделения драгоценных металлов из различных видов производственных растворов и последующего их получения в высокочистом виде разработаны усовершенствованные технологические маршруты, ключевым звеном которых является экстракционный этап переработки.
Установлены наиболее подходящие химические соединения, подлежащие экстрагированию, и проанализирован механизм химических превращений, сопровождающих процессы экстракции. Это позволило обосновать и разработать технологические подходы к концентрированию и аффинажу драгоценных металлов. Среди перспективных экстрагентов особое внимание уделяется органическим соединениям класса сульфидов и сульфоксидов, представляющим собой относительно новое поколение реагентов для извлечения благородных металлов.
В основе методики переработки шламов, образующихся при электролизе меди и никеля, лежит метод вскрытия этих материалов в жидкой фазе с применением хлора в газообразной форме в условиях кислой среды. Как альтернатива соляной кислоте могут использоваться сернокислые растворы, обогащенные хлоридом натрия, что позволяет расширить технологические возможности.
При соблюдении оптимального температурного режима в пределах 70…80 °С и концентрации свободной кислоты на уровне 70…80 г/л, процесс выщелачивания завершается в течение 3,0…3,5 часов. В этих условиях достигается практически полное растворение металлов платиновой группы, золота и меди, а также переход в раствор 50…70 % никеля и 40…75 % железа. Конечные растворы содержат до 2,5…4,5 г/л драгоценных металлов и до 50…60 г/л цветных компонентов и железа.
Активные исследования применения алифатических сульфидов и сульфооксидов как экстрагирующих агентов начались во второй половине XX века. Были разработаны подходы к извлечению золота из хлоридных растворов, серебра – из нитратных, а платиновых металлов – из растворов, содержащих хлориды, нитриды, нитраты и сульфаты.
Одним из ключевых факторов, определяющих степень извлечения металлов платиновой группы (Pt, Rh, Ir, Ru) в органическую фазу, является повышение температуры экстракционного взаимодействия до значений в диапазоне 100…160 °С. Это позволяет существенно повысить эффективность процесса.
Извлечение золота и серебра осуществлялось с использованием 50 %-ного раствора трибутилфосфата (ТБФ) в керосине при фазовом соотношении V0:VB=1:10. После этого рафинаты направлялись на извлечение палладия с помощью экстракции нефтяными сульфидами (НС) также при соотношении фаз 1:10. Температурные условия проведения экстракции для платины составляют 85…90 °С, а для родия, иридия и рутения – в пределах 135…140 °С, при этом обеспечивается интенсивное перемешивание фаз. Контакт фаз в процессе извлечения палладия продолжается порядка 50…60 минут, тогда как для платины и сопутствующих металлов – до 2 часов.
Для оптимизации расхода органических растворителей и регулирования кинетики экстракции предусмотрена предварительная подготовка растворов. Этот этап включает хлорирование рафината, полученного на стадии выделения золота, с последующим нагревом до 90…95 °С, что обеспечивает удаление избытка окислителей. Данные, представленные в таблице 1, демонстрируют высокие степени извлечения металлов и четкое распределение компонентов по фазам. Суммарное содержание драгоценных металлов в финальном рафинате не превышает 0,6…0,8 мг/л.
| Материал | Температура экстракции, °С |
Извлечение при экстракции, % | Содержание в концентрате, % | ||||||||||
| Pt | Pd | Rh | Ir | Ru | P | tPd | Rh | Ir | u | Au | Ag | ||
| Раствор хлорирования шлама электролиза в соответствии с ГОСТ никеля |
20…25 85…95 135…145 |
0,1 98,2 0,99 |
99,90 0,05 — |
0,0 5,4 99,9 |
0,0 9,8 92,4 |
0,0 4,8 95,6 |
0,9 осн. 14,9 |
осн 2,1 0,9 |
0,06 6,8 56,8 |
0,0 1,6 9,1 |
0,0 3,4 24,2 |
0,9 0,0 0,0 |
0,2 0,0 2,1 |
| Шлама: Электролиза меди |
20…25 | 0,8 | 99,9 | 0,0 | 0,0 | 0,0 | 1,4 | осн. | 0,08 | 0,0 | 0,0 | 0,98 | 0,0 |
| 85…95 | 98,0 | 0,15 | 14,1 | 0,15 | 8,2 | осн. | 1,9 | 7,7 | 1,0 | 3,1 | 0,0 | 0,0 | |
| 135…145 | 1,8 | 0,09 | 99,8 | 92,2 | 92,2 | 16,3 | 1,6 | 40,0 | 6,0 | 23,0 | 0,16 | 9,0 | |
| Кека огарка медного шлама |
20…25 | 0,2 | 99,9 | 0,0 | 0,0 | 0,0 | 1,8 | осн | 0,08 | 0,0 | 0,0 | 1,6 | 0,0 |
| 85…95 | 98,5 | 0,26 | 6,9 | 0,4 | 7,6 | осн. | 2,7 | 6,1 | 0,09 | 1,2 | 3,0 | 0,0 | |
| 135…145 | 2,1 | 0,05 | 98,9 | 91,8 | 94,6 | 16,8 | 1,5 | 41,0 | 5,7 | 23,9 | 0,25 | 8,8 | |
Благодаря высокой сорбционной емкости сульфидов – до 50 % по палладию, 45…50 % по платине и до 22 % по родию, иридию и рутению – реализуется эффективный способ концентрирования с последующим термическим разложением. Это дает концентраты с содержанием основного компонента до 98 % по палладию, до 96…98 % по платине и смешанный концентрат до 75 % от суммы благородных металлов. В процессе хлорирования медных шламов (5…7 г/л селена) происходит восстановление селена с осаждением до 85 % в концентрат.
Из-за высокой чистоты палладиевого экстракта разработан альтернативный путь выделения металла без перегонки органики – через его реэкстракцию аммиачной водой и последующее выделение дихлородиаминопалладия. Одна перекристаллизация приводит к получению палладия высокой степени чистоты.
Перспективные пути развития технологии включают: уменьшение количества технологических этапов, снижение рабочих температур при экстракции платины и сопутствующих металлов, а также изменение схемы регенерации органических растворителей для минимизации их потерь.
Возможно также внедрение двухстадийной экстракции золота, палладия и платины при температуре окружающей среды. На первом этапе осуществляется извлечение золота и палладия нефтяными сульфидами, затем добавляется однохлористая медь (3…5 г/л) для извлечения платины. Последующие металлы извлекаются в условиях высокотемпературной экстракции (135…140 °С), как показано на рисунке 1.
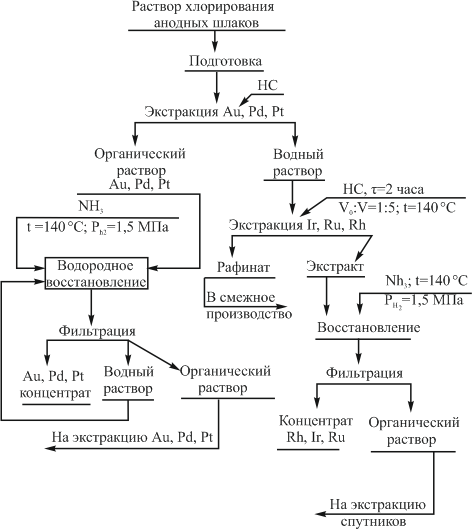
Рисунок 1 – Технологическая схема получения концентратов из растворов хлорирования шламов электролиза меди и никеля
Для интенсификации процесса восстановления применяется усовершенствованная трехфазная система, включающая органический экстрагент, раствор аммиачной воды и водород. Завершение реакции восстановления достигается за 40 минут, при этом формируются легкофильтруемые осадки целевых металлов. Органический растворитель, прошедший стадию регенерации, практически полностью сохраняет свою экстракционную способность и может быть повторно использован. Концентраты благородных металлов, образующиеся после регенерации экстрагента, характеризуются высоким качеством и чистотой.
Современные технологии получения платиновых концентратов, в том числе концентрата ПК-3, базируются на экстракционных методах с использованием технических аминов в роли растворителей комплексов благородных металлов. На экстракционную стадию поступают сульфатные растворы, полученные в результате анодного растворения в цепочке переделов меди и никеля. Однако перед началом экстракции сульфатные комплексы металлов предварительно переводятся в хлоридные формы, более предпочтительные для органической извлекающей среды. Среди недостатков классической технологии — ограниченный уровень извлечения иридия в органическую фазу (около 90%), необходимость поддержания высокой температуры (135–140 °C) и не слишком высокая концентрация целевых компонентов в конечных продуктах (всего 20–22 %), а также значительные необратимые потери органической составляющей.
С целью устранения вышеуказанных технологических ограничений были предложены усовершенствования технологической схемы, ориентированные на использование органических сульфидов и сульфооксидов в качестве экстрагентов для извлечения металлов из сульфатных и смешанных сульфатно-хлоридных растворов. Применение сульфидов не позволяет существенно снизить температуру процесса, однако за счёт высокой селективности экстрагентов существенно улучшается состав концентратов: содержание суммы благородных металлов может достигать 61 %.
Более перспективным направлением признана экстракция сульфооксидами, особенно после предварительной подготовки раствора путем введения двухлористого олова (SnCl2), что приводит к образованию SnCl-3 комплексов. При продолжительном прогревании раствора происходит включение SnCl-3 групп во внутреннюю сферу смешанных хлоридно-сульфатных соединений, благодаря чему в водной фазе формируются соединения с повышенной реакционной способностью — они легко подвергаются внутрисферному обмену с молекулами экстрагента.
Те металлы платиновой группы, экстракция которых ранее ограничивалась скоростью химической реакции, теперь подвергаются лимитирующему влиянию диффузионных процессов.
В состав поступающего на экстракцию сернокислого раствора входят следующие компоненты (г/л):
- никель — 70–80;
- медь — 1,8–3,5;
- железо — 11–15;
- селен — 0,01–0,03;
- цинк — 0,01–0,02;
- свинец — 0,02–0,03;
- платина — 0,0015;
- палладий — 0,002–0,003;
- родий — 0,006–0,008;
- рутений — 0,007–0,009;
- иридий — 0,012–0,023;
- золото — 0,0001;
- серебро — 0,030–0,040;
- серная кислота — 75–80.
Драгоценные металлы в растворе находятся в форме различных сульфатных и комплексов с сульфатом, гидроксидом и водой.
Преобразование сульфатных форм иридия в хлоридные достигается добавлением хлорида натрия (90–100 г/л) и последующим нагревом в течение 4,0–4,5 ч при температуре 103–105 °С. При этом достигается оптимальное соотношение α = ZnCl2/ΣМПГ = (25–30):1 для синтетических растворов. В случае промышленных растворов требуется значение α > 1000 из-за существенного участия SnCl2 в окислительно-восстановительных реакциях, при которых олово (II) восстанавливает элементы вроде селена, теллура, меди (II), железа (III) и соединения платиноидов до более низких степеней окисления. При этом SnCl-3-группы образуют устойчивые координационные комплексы с восстановленными ионами.
Удаление из раствора меди, теллура, селена, а частично — и платины, палладия, родия, рутения осуществляется методом цементации с использованием алюминиевой пудры (2,0–2,5 г/л). Восстановитель добавляется дробно на протяжении всего периода нагрева.
После этого в фильтрате содержится (г/л):
- никель — 73–76;
- медь — 0,03–0,05;
- железо — 10–12;
- цинк — 0,01–0,02;
- свинец — 0,003–0,005;
- селен — 0,001–0,003;
- платина — 0,0001;
- палладий — 0,0002;
- родий — 0,0001;
- рутений — 0,001–0,003;
- иридий — 0,012–0,018;
- серебро — 0,003–0,005.
При этом иридий остаётся в растворе, не восстанавливаясь. Полученный раствор подвергается дальнейшей обработке: его снова нагревают в присутствии 2,0–2,5 г/л олова (в форме SnCl2) при температуре 103–105 °С в течение 4,0–4,5 ч.
Процесс экстракции иридия проводится при температуре 20 °C в течение 30 минут с перемешиванием и соотношением фаз V0:VB=1:10. В качестве экстрагента используется 25 % раствор HCO в керосине, дополненный 15 % октилового спирта. После 50 циклов контакта с производственным раствором содержание металлов платиновой группы в рафинате не превышает 0,8–0,9 мг/л. Для удаления остатков олова предусмотрена дополнительная цементация с алюминием (0,4–0,6 г/л) при температуре 20 °С в течение 15–20 минут. Содержание олова в очищенном растворе после фильтрации — не более 0,1–0,3 мг/л. Образовавшуюся оловянную губку повторно используют для получения SnCl2.
Цинковая пыль используется для осаждения иридия и других ПГМ из органической фазы. Расход восстановителя превышает стехиометрический в 30–40 раз. Температура процесса — 50–60 °С, длительность — 30 минут с активным перемешиванием. При этом восстанавливается до 86 % иридия и почти 100 % остальных металлов. После отделения фаз осадок промывают тёплым 2–3% раствором серной кислоты для удаления избыточного цинка. Далее он используется для подготовки новой порции сульфатного раствора. В процессе подготовки электролита часть олова переходит в раствор, за счёт чего концентрат ПГМ обогащается. Осадок фильтруют, получая продукт, содержащий до 40 % благородных металлов: 35 % иридия, 3–4 % рутения, 2 % родия, 0,3 % платины и 0,2 % палладия.
Органическая фаза после цементации регенерируется промывкой 2М раствором NaOH, полностью восстанавливая свою экстракционную способность, что является ключевым фактором в повышении экономической эффективности предлагаемой схемы.

Рисунок 2 – Технологическая схема извлечения драгоценных металлов из сульфатных растворов
Уникальной особенностью этой технологической стратегии является отсутствие промежуточных незавершённых стадий извлечения ценных элементов: за счёт интеграции промышленных продуктов и их полной переработки в один товарный концентрат достигается высокая степень замкнутости. Это реализуется путём замены двухлористого олова на цементат, состоящий из олова и иридия, полученный на предыдущей стадии регенерации органического растворителя.
Присутствие в растворе вновь восстановленных компонентов, таких как медь, селен, теллур, палладий и другие, не оказывает влияния на эффективность обработки. Однако концентрат, получаемый в результате, отличается высоким содержанием меди, количество которой в 80–100 раз превышает содержание металлов платиновой группы. Это делает рациональным проведение дополнительного обогащения концентрата, которое возможно осуществить с применением хорошо известных технологий. После удаления меди посредством выщелачивания состав концентрата стабилизируется и содержит порядка 28–30 % благородных металлов, в том числе 16–18 % иридия.
Несмотря на эффективность, технология сопровождается рядом недостатков. К ним относится использование широкого перечня химических реагентов, применение которых сопряжено с трудностями в условиях сопряженных производств и высокой стоимостью.
В рамках оптимизации технологического процесса была создана альтернативная схема, которая исключает стадию экстракции при выделении иридия, рутения и родия из сульфатных электролитных растворов. Ключевой основой подхода является установленная реакционная способность соединений благородных металлов в присутствии SnCl2: они способны вступать как во внутримолекулярные превращения с участием сульфидов и сульфооксидов, так и в восстановительные процессы, приводящие к осаждению восстановленных форм без необходимости повышения температуры.
Алюминиевый порошок играет роль восстановителя в процессе цементации благородных металлов, включая иридий. Продолжительность цементации составляет 20–25 минут, и на ее эффективность практически не влияет уровень кислотности или температура среды. По завершении процесса содержание остаточного иридия в фильтрате не превышает 0,8–1,0 мг/л, а расход алюминия составляет около 10 г/л.
Особый акцент в технологическом процессе делается на совместное осаждение олова и иридия. Степень извлечения олова напрямую зависит от температуры раствора, концентрации свободной серной кислоты и дозировки алюминия. Практически полное осаждение олова достигается при температуре 20 °С, дозировке алюминия 6–8 г/л и перемешивании в течение 15–20 минут. Следует отметить, что даже при низком содержании свободной серной кислоты (~15 г/л), повышение температуры до 60–80 °С резко увеличивает потребление алюминия и удлиняет продолжительность процесса.
Наиболее эффективные условия для полного осаждения олова включают: содержание свободной H2SO4 в пределах 15–18 г/л, температурный диапазон от 20 до 40 °С, расход алюминиевого восстановителя 6–7 г/л и длительность цементации от 30 до 40 минут. Эти параметры способствуют не только глубокому удалению олова, но и одновременному выделению практически всего присутствующего иридия из раствора. На основании экспериментальных данных была выстроена технологическая последовательность операций, наглядно представленных на рисунке 3.
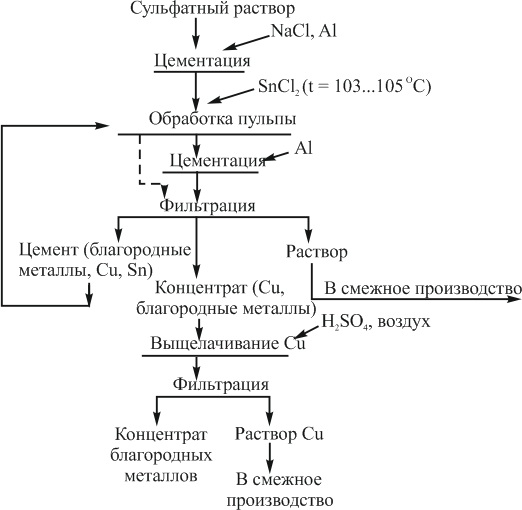
Рисунок 3 – Технология извлечения драгоценных металлов из сульфатных растворов цементацией
Технологическая цепочка включает следующие ключевые стадии:
- удаление сопровождающих иридий элементов (медь, теллур, селен, платина, палладий, рутений и родий) методом цементации;
- введение в пульпу соединений SnCl2 либо олово-иридиевого цементата для активации осаждения целевых компонентов;
- охлаждение раствора до температуры 20–30 °С для создания оптимальных условий для осаждения;
- цементационное извлечение иридия и олова при помощи алюминиевого порошка;
- удаление меди из сформированного осадка с высоким содержанием олова путем выщелачивания.
Разрабатываемая схема не нуждается в применении дорогостоящих автоклавных установок, как и в использовании органических экстрагентов. Потери олова за один цикл переработки составляют менее 0,01 %, что делает технологию экономически оправданной и устойчивой в длительной перспективе. Частая регенерация олова не требуется, благодаря его почти полному возврату в систему.
Преимущества технологии:
- Высокая селективность – применение сульфидов и сульфооксидов позволяет избирательно извлекать отдельные благородные металлы даже из сложных многокомпонентных растворов.
- Глубокая степень извлечения – достигается до 98 % по палладию, 96–98 % по платине и около 75 % по смешанным концентратам.
- Возможность регенерации экстрагентов – органические компоненты успешно восстанавливаются для повторного использования, снижая эксплуатационные расходы.
- Комплексность переработки – технологии ориентированы на замкнутый цикл и минимизацию отходов, что повышает экологическую безопасность.
- Универсальность – применимы к различным видам промышленных растворов: хлоридным, сульфатным, нитратным.
Недостатки:
- Высокие температуры экстракции – особенно для родия, иридия и рутения (до 140 °С), что увеличивает энергозатраты.
- Большое количество реагентов – требуются хлор, SnCl₂, NaCl, органические экстрагенты, аммиачная вода и др., что осложняет логистику.
- Частичная потеря экстрагентов – несмотря на регенерацию, часть органики уходит в отходы или теряет активность.
- Токсичность и взрывоопасность некоторых веществ – требует строгих условий безопасности при эксплуатации.
- Высокое содержание меди в концентрате – требует дополнительного обогащения и очистки.
Интересные факты:
- Сорбционная ёмкость сульфидов достигает до 50 % по палладию, что делает их одними из самых эффективных экстрагентов.
- Температурный режим влияет на выбор металлов для экстракции: платина извлекается при 85 °C, родий — при 135 °C.
- Цементация алюминием позволяет не только выделять иридий, но и одновременно осаждать олово — без необходимости изменения кислотности среды.
- Экстрагенты сохраняют активность даже после 50 циклов использования, при условии правильной регенерации.
- Снижение стадийности процесса позволяет получать товарные концентраты без промежуточных очисток — это уникально для переработки шламов.
Экстракционные методы с применением органических сульфидов и сульфооксидов представляют собой мощный инструмент в области переработки промышленных растворов с целью извлечения и очистки драгоценных металлов. Несмотря на отдельные технологические сложности и высокие требования к условиям проведения процессов, они позволяют достигать высокой степени извлечения, минимизировать потери и формировать товарные концентраты с высокой чистотой. Постоянные научные разработки и совершенствование технологических схем позволяют надеяться на дальнейшее расширение области применения данных решений и снижение издержек при сохранении экологической и экономической эффективности.
