Содержание страницы
Защитные среды и покровы при плавке драгоценных металлов применяют для предохранения шихты и расплава от окисления, от насыщения кислородом и другими газами плавильного пространства, а также обеспечения непосредственной дегазации расплавов и их раскисления. Одновременно с этим защитный покров, обладая высокими теплоизолирующими свойствами, служит для теплоизоляции шихты и расплава и обеспечивает тем самым интенсификацию процесса и сокращение расхода тепла на плавку.
Назначение флюса – пирометаллургическое рафинирование расплава от не растворяющихся в нем оксидных и других включений с переводом этих включений в легкоплавкие шлаки. Одновременно защитно-рафинировочные флюсы обеспечивают теплоизоляцию поверхности расплава, защиту расплава от окисления, насыщения его кислородом и другими газами из плавильного пространства, а в ряде случаев также и дегазацию.
Назначение раскислителей это восстановление окисленных компонентов расплава до металлов для повышения качества отливаемых слитков, а также обеспечения минимальных потерь металлов на угар и минимизации отходов, т.е. повышение металлургического выхода. В основе процесса раскисления лежат реакции химического вытеснения кислорода из оксидов основных и легирующих компонентов расплавов другими, более активными веществами.
Общая конечная цель применения всех защитных сред, покровов, флюсов и раскислителей при плавке металлов — обеспечение наименьших потерь металлов и получение хорошего качества расплава, свободного от растворенных газов, оксидных и шлаковых включений, плен и дефектов металлургического характера. Однако следует иметь в виду, что указанной цели при применении защитных сред или покровов, защитных и окислительно-рафинировочных флюсов и раскислителей можно достигнуть только при правильном выборе их и строгом соблюдении правил подготовки к работе и использования. Иначе возможен обратный эффект — порча расплава, снижение качества обрабатываемых слитков, брак полуфабрикатов и изделий по пористости, пленам, трещинам и другим металлургическим дефектам, а также повышенные потери металла на угар и с отходами, как в процессе плавки, так и на последующих операциях производства полуфабрикатов и изделий.
При выборе защитных сред, покровов, флюсов и раскислителей необходимо учитывать характер их взаимодействия с расплавами и отдельными компонентами расплава, футеровкой печи (тигля), плавильными приспособлениями и т.п. Кроме того, надо учитывать сравнительную эффективность применения различных сред, покровов, флюсов и раскислителей, их стоимость и доступность, а также возможность применения по условиям охраны труда и техники безопасности, так как в этой части далеко не все из них могут быть рекомендованы к применению. Например, древесный уголь один из лучших защитно-дегазационных покровов при плавке серебра и его сплавов непригоден для платины, металлов платиновой группы, а также сплавов серебра и золота с высоким содержанием платины, металлов платиновой группы и никеля. Эти металлы и сплавы при нагреве и плавке в присутствии углерода подвержены сильному науглероживанию. Совершенно недопустимо применение угля для всех металлов и сплавов в случае проведения плавок с применением поташа или калиевой селитры, так как при нагреве в присутствии углерода эти флюсы образуют взрывоопасные соединения. Применение с древесным углем других флюсов — соды вместо поташа или натриевой селитры вместо калиевой – допустимо, а в ряде случаев и весьма желательно.
Флюс – сода кальцинированная – широко применяется при плавке сплавов серебра и золота. Однако небезразлично, в каком состоянии, при каких температурах и для каких сплавов ее применять, так как в зависимости от этих факторов можно получить прямо противоположные результаты. Так, для сплавов, содержащих компоненты, загрязнения и примеси, более активные к кислороду, чем натрий, сода будет служить окислителем этих компонентов, загрязнений и примесей, выполняя одновременно роль дегазатора. В сплавах, где отсутствуют более активные компоненты, загрязнения и примеси, сода будет выполнять роль нейтрального и даже восстановительного защитно-дегазационного флюса. Кальцинированную соду необходимо применять после прокаливания при температуре до 1300 °С. В присутствии же влаги, особенно при нагреве выше 1300 °С, сода для этих сплавов будет сильным окислителем, который может перевести в шлак не только загрязнения, примеси и компоненты, но и драгоценные металлы.
В ряде случаев при выборе защитных сред или защитных покровов, флюсов и раскислителей необходимо учитывать возможность загрязнения ими расплавов при плавке, если это загрязнение недопустимо по условиям назначения сплава. Например, известно, что фосфористая медь — один из лучших раскислителей при производстве серебряно-медных и ряда других сплавов. Однако при производстве сплавов для электротехнических целей применять фосфористую медь нежелательно, так как она может загрязнить сплавы фосфором и резко снизить их электропроводность. В этих случаях следует применять другие раскислители.
Для правильного выбора сред, покровов, флюсов и раскислителей важен учет степени летучести металлов при плавке в присутствии этих материалов, а также различных по характеру и количеству примесей, загрязнений и компонентов. Драгоценные металлы, несмотря на высокую стойкость против окисления и сравнительно высокие температуры плавления и кипения, в ряде сред, в зависимости от присутствия других элементов, улетучиваются при температурах ниже температуры их кипения, а иногда даже ниже температуры плавления. В частности, серебро (температура плавления 960,8 и кипения 2193 °С) начинает улетучиваться в вакууме уже при 850 °С. Потери серебра при 1055 °С в оксиде углерода и углекислом газе в 2 раза меньше, чем в азоте, и в 3 раза меньше, чем в воздухе и кислороде. С повышением температуры потери серебра во всех этих средах растут, но далеко не в одинаковой степени.
При повышении температуры до 1160 °С быстрее всего растут потери серебра в углекислом газе (в сравнении с потерями при 1055 °С они увеличиваются в 9 раз), медленнее в оксиде углерода (в 4,3 раза), еще медленнее в кислороде и воздухе (соответственно в 3,6 и 3,2 раза) и еще меньше в азоте (в 2,6 раза). При дальнейшем повышении температуры на 100 °С значительно растут потери серебра в азоте, кислороде в воздухе (в сравнении с потерями при 1160 °С они увеличиваются соответственно в 3,3; 3,2 и 3 раза). Потери серебра в оксиде углерода при 1160…1200 °С много ниже, чем в кислороде (в 3,0…3,3 раза), воздухе (в 2,7…2,8 раза), углекислом газе (в 2,1…2,3 раза) и азоте (в 1,2 раза). При добавке меди к серебру, как правило, увеличиваются его потери в указанных средах, причем тем сильнее, чем выше температура нагрева расплава. Исключение составляет добавка меди (до 50 %) к серебру в среде углекислого газа при температурах до 1055 °С, когда потери серебра не возрастают. Добавка золота (25 %) к серебру до 1055 °С заметно снижает его потери в углекислом газе и несколько в кислороде, но заметно увеличивает их в азоте. При дальнейшем повышении температуры во всех указанных средах потери сплава серебра с 25 % золота резко возрастают, превышая потери в этих средах для чистого серебра.
Положение аналогичное с некоторыми изменениями по потерям расплавов серебра с платиной, оловом и сурьмой. Увеличивается летучесть серебра при плавке и литье в воздушной атмосфере в присутствии большого количества оксидов других металлов, что объясняется образованием устойчивого при высоких температурах оксида серебра.
Золото (температура плавления 1063 и кипения 2966 °С) начинает улетучиваться в вакууме при 970 °С. В атмосфере кислорода, азота и углекислого газа потерь расплавленного золота нет. В атмосфере водорода, оксида углерода и воздуха потери золота имеются, причем в водороде они наблюдаются с 1200 °С и составляют при 1250 °С за 25 мин. 0,055 %, в то время как в воздушной среде за то же время уже при 1125 °С составляют 0,0417 %, а при 1250 °С 0,108 %, или в 1,97 раза больше, чем в водороде; потери золота в атмосфере оксида углерода вдвое больше, чем в воздухе. Особенно велики потери золота в атмосфере хлора: уже при 150 °С составляют 0,007 % и очень резко возрастают при повышении температуры, достигая 2,32% при 300 °С, 0,58 % при 590 °С и 1,93 % при 1100 °С.
Летучесть золота в воздушной среде возрастает в присутствии платины, свинца, никеля, висмута, кадмия, меди, мышьяка, ртути, сурьмы, цинка и теллура (ниже 1100 °С теллур не вызывает роста летучести золота). При 1100 °С летучесть золота увеличивается при добавке 5 %: платины — в 1,9 раза, свинца или никеля — в 2,5 раза, висмута — в 4,2 раза, кадмия или меди — в 4,6 раза, мышьяка — в 6,7 раза, ртути — в 7,5 раза, сурьмы — в 8,3 раза, цинка — в 13,3 раза, теллура — в 25,0…33,3 раза. Кислород, азот, углекислый газ и хлор от первого к последнему повышают летучесть золота в сплавах с цинком и кадмием. В кислороде добавка серебра к золоту увеличивает летучесть золота за счет взаимодействия серебра с кислородом, причем в большей степени, чем больше добавка серебра. При плавке золото-сурьмянистых сплавов в углекислом газе летучесть золота выше, чем в азоте и кислороде.
Платина и металлы платиновой группы имеют температуры плавления выше 1550 и кипения 3900 °С, однако летучесть их в вакууме наблюдается уже при 1000 °С, причем на первом месте по летучести из них стоит Оs, затем Ru, Ir, Pd, Pt и, наконец, Rh. Платина и металлы платиновой группы менее летучи в восстановительной и более в окислительной атмосфере и в атмосфере хлора. В этих средах летучесть меньше у платины, родия и иридия и больше у осмия, рутения и палладия. В атмосфере воздуха потери металлов платиновой группы и платины очень малы — до 1300 °С, причем до 900 °С платина и родий практически их не дают, а потери палладия, за 30 и иридия за 22 час нагрева составляют 0,18 и 0,09 %. Выше 1300 °С родий летит быстрее платины.
Примеси других металлов повышают летучесть платины и металлов платиновой группы. В воздушной атмосфере добавление родия в платину уменьшает потери, а палладия увеличивает их. В интервале температур 1000…1200 °С потери платины в водороде, азоте и вакууме незначительны. Добавление иридия к платине в этих средах сильно увеличивает ее потери: 1 % иридия при 1000 °С увеличивает потери платины почти в 4 раза, а 2,2 % иридия — в 7 раз, 1 % иридия при 1200 °С увеличивает потери платины в 1,5 раза, а 2,2% иридия — в 3,1 раза. Добавление родия в этих средах, наоборот, уменьшает потери платины: при 1000 °С в 1,14 раза и при 1200 °С в 1,5 раза. В кислороде при 1670…2170 °С потери платины больше, чем в ,вакууме и т.д.
При выборе необходимых сред, покровов, флюсов и раскислителей для плавки и литья драгоценных металлов и сплавов наряду с летучестью металлов необходимо учитывать также склонность в расплавленном состоянии драгоценных металлов и входящих в их сплавы других компонентов к интенсивному поглощению ряда газов и характер взаимодействия с ними. Например, расплавленное золото способно поглощать до 0,25, а в атмосфере углекислоты — до 7,8 частей воздуха на 1000 частей металла. Один объем расплава золота может поглотить 37…46 объемов атомарного водорода и 33…46 объемов кислорода. Серебро в воздушной атмосфере при плавке поглощает до 22 объемов кислорода, который интенсивно выделяется при кристаллизации расплава, вызывая разбрызгивание последнего, а также наросты и вздутия на поверхности отлитых слитков. При кристаллизации серебра в восстановительной атмосфере возможность образования газовой пористости в отлитых слитках возрастает вследствие взаимодействия выделяющегося из расплава кислорода с водородом или другим восстановительным газом.
Пары воды и углекислый газ на расплавленное серебро влияют весьма мало, поскольку упругость разложения оксида серебра значительно выше упругости диссоциации этих газов. Атомарный водород растворяется как в твердом, так и в расплавленном серебре. С повышением температуры растворимость вначале растет, а затем падает вследствие повышения упругости паров серебра. Водород, углеводороды и оксид углерода являются восстановителями оксида серебра — дегазаторы кислорода. Сплавы серебра с медью занимают по отношению к растворимости кислорода и водорода и взаимодействию с ними промежуточное положение между серебром и медью. Кислород в этих сплавах находится в виде диоксида меди, которая сама может содержать в растворе небольшое количество диоксида серебра. Атомарный водород в этих сплавах растворяется, но не пропорционально составу. Растворимость водорода в расплавах серебра с медью выше, чем в твердых сплавах, вследствие чего при затвердевании расплавов из них выделяется излишек водорода в виде пузырей. Аналогично действуют на эти сплавы, хотя и в несколько меньшей степени, углеводороды. Азот и оксид углерода на серебряно-медные сплавы вредно не действуют.
Платина и палладий склонны к поглощению большого объема кислорода, который при литье и кристаллизации расплавов выделяется, вызывая их разбрызгивание и образование пузырей в слитках.
Растворимость атомарного водорода в платине значительно меньше — заметная растворимость (4 см3 в 100 г металла) наблюдается свыше 900 °С. Наоборот, палладий очень интенсивно поглощает водород; в порошкообразном состоянии он способен поглотить до 1000 объемов водорода.
1. Защитные среды
Вакуум – наиболее эффективная, но и весьма дорогая защитнодегазационная среда. Для осуществления требуется специальное плавильное оборудование, что ограничивает его применение. Недостаток, ограничивающий применение вакуума, — повышенная по сравнению с другими защитно-дегазационными средами летучесть в нем металлов и сплавов при плавке. Это прежде всего относится к сплавам, содержащим кадмий, цинк и фосфор.
Вакуум рекомендуется применять для защиты от окисления и дегазации при плавке палладия, родия, осмия, рутения и высокопробных сплавов палладия с серебром, медью и никелем (ПдСр-20, ПдСрН-13-2, ПдСрМ-13-2). Можно применять в тех же целях при плавке платины и иридия, а также высокопробных сплавов платины и металлов платиновой группы.
Вакуум над расплавом следует поддерживать в течение всего времени плавки или 1,5…2,0 мин. непосредственно перед литьем, если преследуется цель только дегазации расплава, а от окисления его лучше защищать иными средами. Степень разрежения 50…100 мм рт. ст.
Аргон и гелий – инертные газы, химически не реагирующие ни друг с другом, ни с каким-либо иным веществом и исключительно диффузионно пассивные по отношению к металлам и сплавам. Химическая инертность и диффузионная пассивность инертных газов объясняются законченным устойчивым строением электронных оболочек их атомов, которые характеризуются максимальным числом во внешнем слое свободных электронов азимутного квантового числа: l=0 в слое К и l=1 во всех других слоях, что обусловливает большие размеры атомов этих газов по сравнению не только с размерами атомов, но и молекул всех других (не инертных) газов, а также атомов большинства металлов и металлоидов (Ag, Аu, Pt, Pd, Ir, Rh, Os, Ru, Сu, Ni, Cd, Zn, Co и др.), размеры атомов которых равны или немного больше размеров атомов инертных газов. Столь ценные качества инертных газов позволяют гарантированно защищать и одновременно дегазировать любой металл и сплав при плавке. Однако применение инертных газов в этих целях ограничивается сравнительно высокой их стоимостью, а также необходимостью создания специальных приспособлений для их подготовки к работе, поскольку при поставке они содержат до 0,3 % кислорода и влагу и потому не могут непосредственно использоваться по назначению.
Аргон и гелий рекомендуется применять для защиты от окисления, предотвращения насыщения другими газами и одновременной дегазации за счет пониженного парциального давления при плавке платины, металлов платиновой группы и их сплавов, особенно палладия, осмия, рутения, а также золота. Могут применять в тех же целях при плавке золотомедных, золото-никелевых и других сплавов золота, не содержащих серебра и особенно цинка, вследствие образования устойчивого при высоких температурах летучего оксида серебра и повышенной летучести золота в этих средах в присутствии цинка. Перед применением аргон и гелий должны быть очищены от кислорода и других газов пропусканием их через щелочной раствор перманганата или хромовой смеси. Для очистки от кислорода аргон и гелий пропускают через раскаленные железные опилки, а обезвоживание проводят путем пропусканием через крепкую (но не концентрированную) серную кислоту или сухой хлористый кальций. Еще тщательнее осушаются газы пропусканием через фосфорный ангидрид. Очистка газов от кислорода и влаги перед использованием в работе обязательна, так как иначе будет не защита и дегазация, а насыщение расплавов кислородом и парами воды.
Применение защитных газовых сред эффективно, если шихты и расплавы будут непрерывно находиться под их положительным давлением, для чего защитный газ следует подавать в печь (тигель) в процессе всей плавки под давлением более 1 атом, а в период литья — также на струю расплава и в изложницу.
Азот молекулярный технический (N2) – газ практически нейтральный по отношению к многим металлам и сплавам, в том числе драгоценным, при обычных и повышенных температурах, вследствие чего хорошо защищает и одновременно дегазирует их при плавке. Азот обладает большой пассивностью диффузии во многие металлы и сплавы. Диффузия азота для драгоценных металлов и сплавов практически отсутствует (для серебра и золота включительно до 1300 °С). Поставляемый азот содержит влагу и до 0,3 % кислорода, ввиду чего
перед его применением необходимо обязательно провести процесс обезвоживания и очистить от кислорода.
Назначение, состояние, режимы применения и метод подготовки азота к работе те же, что и иных инертных газов.
Водород молекулярный технический (Н2) – обладает сильно эндотермической реакцией диссоциации: Н2 + 104 ккал=2Н, которая заметно начинает протекать примерно с 1730 °С, причем с ускорением, чем выше температура; при понижении температуры отдельные атомы водорода вновь соединяются в молекулы. Термическая диссоциация водорода (при обычном давлении) характеризуется следующими данными
| Температура, К | 2000 | 2500 | 3000 | 3500 | 4000 | 5000 |
| Диссоциация, % | 0,088 | 1,31 | 8,34 | 29,6 | 63,9 | 95,8 |
Атомы водорода соединяются в молекулы значительно быстрее на поверхности различных металлов, чем в самом газе, так как в первом случае более интенсивно поглощается избыток освобождающейся эндотермической энергии. Реакция взаимодействия водорода с кислородом протекает: при 400 °С в течение 80 дней, при 500 °С за 2 часа, а при 600 °С моментально со взрывом. В среднем при повышении температуры на каждые 10 °С скорость реакции увеличивается в 3 раза. При отсутствии в шихте более активных по отношению к кислороду компонентов (Са, Th, Mg, Li, Sr, Be, Ba, Al, Zr, Ti, Si, Na, V, Та, Cr, Mn, Nb, K, Ga, Rb, Zn, Cs, In, P, Mo, Sn, Fe, W, Ge, Ni) водород активно взаимодействует при плавке драгоценных металлов и их сплавов с кислородом пространства печи и оксидами всех драгоценных, а также других металлов (Со, Se, Sb, Pb, As, Bi, Те, Tl, Сu) по реакции
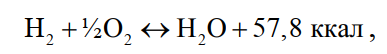 (19)
(19)
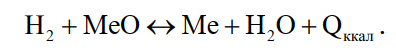 (20)
(20)
В интервале температур 600…2000 К реакции идут вправо до образования паров воды и восстановления оксидов металлов до металлов, свыше 2000 до 4000 К реакции обратимы и свыше 4000 К идут только влево. Расплавы насыщаются водородом при плавке под молекулярным водородом крайне медленно вследствие большой энергии диссоциации его молекул и сравнительно небольшого времени собственно плавки. С понижением температуры растворимость водорода падает для серебра, меди, платины, золота, никеля, кобальта и резко возрастает для палладия, с чем необходимо считаться для предотвращения образования пузырей, трещин и других дефектов. В состоянии поставки технический водород содержит влагу, ввиду чего не может быть непосредственно использован по назначению.
Молекулярный водород рекомендуется применять для защиты от окисления и поверхностного раскисления при плавке платины, палладия, иридия и их сплавов, не содержащих компонентов, более активных к кислороду, чем водород. Особенно желательно применение водорода при плавке сплавов палладия с серебром, иридием, медью, кобальтом и золотом (ПдИ-10, ПдИ-18, ПдСр-40, ПдМ-40, ПдСрМ-36-4, ПдСрК-35-5, СрПд-40, СрПд-20, СрПдМ-30-10), а также при литье серебра (после двойного аффинажа) и катодного (после аффинажа) золота.
Состояние, режимы применения и методы подготовки водорода к работе те же, что и инертных газов. При этом по окончании литья палладия и его сплавов, особенно высокопробных, подача водорода на слиток должна быть сразу же прекращена ввиду интенсификации поглощения водорода палладием при его охлаждении после кристаллизации.
2. Защитные покровы и флюсы
Уголь березовый обычный (кусковой печной или лучше кучной) или активированный марки БАУ-2 или (лучше) их смесь в соотношении 1:1 по массе в прокаленном состоянии — хороший теплоизолятор, имеющий коэффициент теплопроводности 0,064 ккал/(м·час·град). Наиболее дешевый и эффективный защитный и дегазационный покров при плавке многих металлов и сплавов, не реагирующих (обязательное условие) или слабо реагирующих с углеродом и его оксидами (СО и СО2).
Древесный уголь содержит в среднем: 88 % С, 7,9 % О, 3,5 % Н, 0,4 % N, 0,2 % S, а также до 6 % общей влаги. Зольность угля до 3%, плотность 1800…2100 кг/м3, сопротивление раздавливанию поперек волокон 10…20 и вдоль 20…40 кгс/см2 температура вспышки 250…300 °С, пористость 70…85 %, содержание и выход летучих при прокаливании 15 %, в том числе влаги 3 %, которая в таком количестве находится даже в сухом угле. На рис. 14 дана зависимость количества выделяющихся из древесного угля адсорбированных газов по их составу от температуры последовательного нагрева и прокаливания угля, из которой видно направление кривых десорбции, восходящих даже при 900 °С.
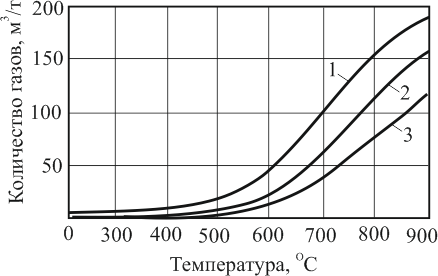
1 – общее количество газов; 2 – количество Н2+СН4; 3 – количество СН4
Рисунок 14 – Зависимость количества выделяющихся адсорбированных газов от температуры нагрева и прокаливания угля
Плавка с плохо прокаленным сырым углем вызывает обильное выделение из него молекулярного водорода, метана, паров воды и кислорода, с последующим взаимодействием паров воды и метана между собой, с раскаленным углем и активными компонентами сплава. В результате взаимодействий образуется атомарный водород, интенсивно диффундирующий в твердую шихту или расплав, если в них присутствуют элементы с большим сродством к кислороду, чем у водорода.
В присутствии древесного угля или метана (около 1000 °С) пары воды активно взаимодействуют с этими элементами, являясь для них окислителем и восстанавливаясь до атомарного водорода.
Аналогично этому протекает реакция между метаном и углекислым газом, которая при высоких температурах нацело смещается вправо. Кроме того, метан сам диссоциирует на углерод и водород уже с 600 °С и выше независимо от присутствия паров воды и углекислого газа, причем кривая диссоциации интенсивно поднимается с повышением температуры и полностью заканчивается при 1000…1100 °С. Вот почему работа с недожженным сырым плохо прокаленным древесным углем при плавке драгоценных металлов и их сплавов недопустима, особенно при температурах, близких к 1000°С и выше.
Нельзя применять при плавке сырые шихты и флюсы, пользоваться для перемешивания расплава деревянными палочками, сырыми графитовыми мешалками и т.п., а также заливать расплав через сырые плохо прокаленные воронки, использовать не прокаленные изложницы, применять влажную смазку и пр. Все это приводит к насыщению металлов водородом и окислению их кислородом влаги и является одной из главных причин последующего брака слитков, полуфабрикатов и изделий по пузырям, пленам, трещинам и др..
В прокаленном состоянии древесный уголь сильно гигроскопичен и обладает наиболее развитой способностью к адсорбции. Адсорбционная способность активированного угля больше, чем обычного кускового. Кусковой уголь поставляется в кусках размером 50…100 мм, а активированный в зернах размером ≈ 5×(10…15) мм.
При отсутствии в шихте более активных по отношению к кислороду компонентов сухой древесный уголь энергично реагирует с кислородом в рабочем пространстве печи, почти со всеми оксидами драгоценных металлов (кроме OsO), а также с оксидами меди, свинца (кроме РbО), теллура, таллия, мышьяка, висмута, сурьмы (кроме Sb2O3) при 400…700 °С и выше.
При недостатке кислорода протекают дополнительные реакции — углекислый газ взаимодействует с раскаленным углем и переходит в оксид углерода, а последний, начиная с 700 °С и выше, может реагировать сам с кислородом и оксидами металлов по реакциям
![]() (21)
(21)
![]() (22)
(22)
![]() (23)
(23)
При этом реакция горения СО при нагреве в интервале 700…1000 °С идет с заметной скоростью только в присутствии следов водяного пара или других газов, содержащих водород. В интервале 400…4000 °С существует равновесие реакций: СО2+С↔2CO и 2СО+О2↔2СО2, из которых следует, что ниже 400 °С равновесие по первой реакции практически полностью смещено влево, а выше 1000 °С — вправо.
Березовый уголь (обычный, активированный или их смесь) применяют для защиты от окисления, теплоизоляции поверхности расплава, дегазации и раскисления при плавке серебра, серебряномедных, золотосеребряных, золото-серебряно-медных сплавов. Также применяют (кроме раскисления) при плавке серебряно-меднофосфористых, серебряно-свинцовых, серебряно-оловянных, серебряно-свинцово-оловянных и других аналогичных припоев, и сплавов, не содержащих или содержащих лишь в небольшом количестве — до 10…15 % платину, металлы платиновой группы, никель и другие компоненты, взаимодействующие с углеродом с образованием карбидов с последующим выделением при кристаллизации. Может быть применен также для плавки и литья золотых и серебряных припоев, содержащих цинк и кадмий, но в этом случае лучше пользоваться свежеприготовленным углем, особенно обработанным в вакууме.
Перед применением уголь должен быть хорошо прокален без доступа воздуха или лучше в вакууме (для гарантированной дегазации) до вишнево-красного цвета. После прокаливания уголь необходимо просеять от мелочи и хранить до использования подогретым выше температуры окружающей среды на 20…50 °С. Оптимальный размер кусков 10…30 мм. Особенно тщательно уголь должен быть прокален при плавке сплавов, содержащих более активные по отношению к кислороду компоненты, чем углерод, так как в их присутствии насыщение расплава газами из угля протекает наиболее интенсивно.
При плавке шихта и поверхность расплава в тигле должны быть полностью закрыты слоем угля толщиной 30…50 мм или в общем случае слоем не менее 0,25 рабочей высоты тигля.
Перед загрузкой шихты на дно тигля рекомендуется уложить 1…2 совка угля на 100…150 кг шихты для создания восстановительной атмосферы в тигле в начале плавки. Когда шихта еще находится в твердом состоянии, необходимо обсыпать рабочую поверхность раскаленного тигля хорошо прокаленной толченой бурой, это повышает стойкость тигля.
Желательно все сплавы и припои, кроме содержащих фосфор, рафинировать небольшими (до 0,3 % от массы шихты) добавками хорошо прокаленной, предварительно проплавленной толченой буры. Добавлять рафинатор следует в два приема — в середине и в конце плавки (после раскисления расплавов, когда раскислитель полностью прореагирует), но не позже чем за 2…3 мин. до разливки, после чего расплав необходимо тщательно перемешать и дать ему немного отстояться.
Натрий борнокислый — бесцветные стекловидные кусочки, получаемые при нагреве до 450 °С так называемой «ювелирной буры» Na2B4O75H2O, при этом она полностью теряет влагу. Плотность натрия борнокислого составляет 2370 кг/м3, а температура плавления 741 °С, он сильно гигроскопичен, во влажном воздухе поглощает воду и мутнеет. Химически не реагирует с большинством металлов и сплавов, в том числе со всеми драгоценными металлами, сплавами и припоями, ни при обычных условиях, ни при нагреве и плавке; не разлагается при этом и хорошо ошлаковывает оксиды многих металлов, в связи с чем является одним из наилучших защитно-рафинировочных флюсов при плавке этих металлов и сплавов.
Сущность рафинирования металлических расплавов бурой и механизм шлакования ею оксидных и других включений из расплавов носит двоякий характер. Шлакование бурой происходит механически. Бура, имея малую плотность, небольшую сравнительно температуру плавления (близкую или почти равную температуре плавления многих сплавов и особенно припоев драгоценных металлов, но много меньше температуры плавления большинства, находящихся в расплаве оксидных и шлаковых включений), а также обладая хорошей смачиваемостью с этими оксидами и включениями, проходит через расплав и легко всплывает вследствие большой разности в плотностях и встречая на своём пути тугоплавкие нерастворимые в расплаве оксиды и другие твердые включения, смачивает, обволакивает их и, увлекает за собой, выносит на поверхность расплава, очищая его подобно механическому фильтру. Поэтому, если буру не замешивать, а только загружать на поверхность расплава в процессе плавки или в конце ее, тогда процесс шлакования оксидов и включений происходить не будет.
Бура химически взаимодействует с оксидными включениями как в толще расплава, так и на его поверхности и этот процесс наиболее важен. Металлические оксиды шлакуются по реакциям типа:
![]() (24)
(24)
![]() (25)
(25)
с образованием легкоплавкого стекловидного (обычно цветного) шлака, легко всплывающего на поверхность расплава, что дает возможность свободно удалять его. Оксиды металлов шлакуются тем интенсивнее, чем больше сродство к кислороду у образующего их металла. Наименьшее сродство драгоценных металлов к кислороду по сравнению с другими металлами дает возможность буре при плавке шлаковать в первую очередь оксиды наиболее вредных для драгоценных металлов примесей: кальция, магния, бериллия, алюминия, кремния, тантала, хрома, марганца, железа.
Это происходит тогда, если в сплаве отсутствуют в качестве компонентов цинк, фосфор, олово, селен, сурьма, свинец, мышьяк, висмут и теллур. При отсутствии в сплавах в качестве компонентов цинка, фосфора, олова, кадмия, никеля, кобальта и примесей других недрагоценных металлов лишь затем шлакуются оксиды драгоценных металлов. В результате такой последовательности шлакования драгоценные металлы в присутствии других, более активных к кислороду компонентов, являются лишь передатчиками кислорода. Плавка сплавов и особенно припоев драгоценных металлов с бурой или с ее добавлением как рафинирующего флюса к другим защитно-дегазационным средам и покровам обеспечивает хорошее рафинирование расплавов от оксидов примесей и загрязнений. При этом обеспечиваются минимальный переход драгоценных металлов в шлак с оксидами.
На этом свойстве буры основано ее применение, прежде всего, при плавке сильно загрязненных и окисленных некомпактных отходов драгоценных металлов и сплавов в виде опилок, шлифов, сора и т.п., образующихся в различных металлургических и обрабатывающих переделах производств.
Если в качестве рафинирующей добавки к другим защитнодегазационным средам и покровам, в частности к древесному углю, используют буру (до 0,3 % от массы шихты), то ее следует вводить в два приема: первый раз в середине плавки и второй в конце (по окончании раскисления) за 1,5…2,0 мин. до разливки металла. После ввода в обоих случаях расплав необходимо тщательно промешать и дать ему немного выстояться.
Березовый кусковой или (лучше) березовый активированный уголь или их смесь в сочетании с натрием борнокислым в соотношении по массе в прокаленном состоянии (1…2):1. Эта композиция может быть применена для плавки серебра и золотосеребряных сплавов, однако в этом случае возможны большие потери серебра, чем при плавке под слоем только древесного угля, за счет ошлакования оксидов серебра в процессе всей плавки.
При загрузке в тигель шихту обильно пересыпают смесью (1 % буры и 1…2 % угля), остальное количество смеси засыпают сверху из расчета, чтобы поверхность расплава была полностью закрыта покровом толщиной 20…30 мм, что отвечает общему расходу на плавку 2…3 % от массы шихты.
Смесь шлаковая в сочетании с березовым кусковым или (лучше) березовым активированным углем в соотношении 1:(1…2) по массе в прокаленном состоянии. Состоит из измельченной до 5…10 мм плавленой буры и углекислого кальция (мела) марки А в соотношении 1:1. Мел марки А содержит не менее 98 % углекислого кальция, магния и не более 1 % нерастворимых в соляной кислоте веществ, 0,2% оксида железа, влаги 2 % в молотом и 12 % в комковом состоянии. Тонкость помола для молотого мела — остаток на сите № 200 не более 1 %. Плотность 2,7…2,9 г/см3. Теплота образования 289,1 ккал/моль, или 96,4 ккал/г-атом кислорода, свободная энергия 207,22 ккал/моль. При нагревании, начиная с 550 °С, диссоциирует по реакции СаСО3+43 ккал↔СаО+СО2↑, причем при нагреве реакция сдвигается вправо и практически заканчивается около 900 °С, что создает при плавке интенсивную дегазацию и рафинирование расплава углекислым газом.
Существует следующая зависимость равновесия диссоциации СаСО3 от температуры
| Температура, °С | 550 | 600 | 650 | 700 | 750 | 800 | 850 | 897 |
| Давление СО2, мм | 0,4 | 1,8 | 6,9 | 22,2 | 63 | 167 | 372 | 760 |
При нагреве совместно с шихтой драгоценных металлов и сплавов шлаковой смеси и древесного угля до температур плавки и в период плавления происходят следующие реакции:
а) горения, окисления и восстановления для металлов с меньшим сродством к кислороду, чем углерод
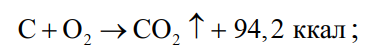 (26)
(26)
![]() (27)
(27)
или
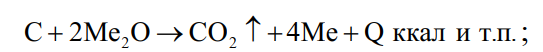 (28)
(28)
![]() (29)
(29)
![]() (30)
(30)
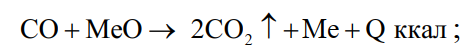 (31)
(31)
или
![]() (32)
(32)
б) шлакообразование
![]() (33)
(33)
или
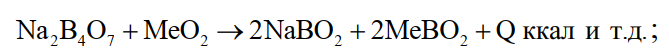 (34)
(34)
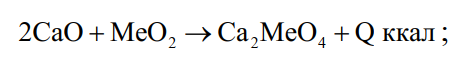 (35)
(35)
![]() (36)
(36)
Кроме того, при раскислении расплавов фосфористой медью и образовании фосфористого ангидрида, если имеется свободная СаО, может дополнительно протекать реакция 3СаО+Р2О5→Са3(РО4)2+164 ккал, что весьма нежелательно вследствие высокой температуры плавления образующегося соединения Са3(РО4)2 (1670 °С), из-за чего в свою очередь возможно протекание следующих реакций с выделением в конечном счете летучих паров фосфора:
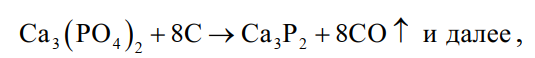 (37)
(37)
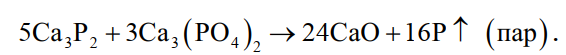 (38)
(38)
Эти реакции особенно хорошо протекают в присутствии SiO2. Однако не следует допускать раскисления сплавов фосфористой медью при шлаковой защите, не убедившись, что СаО полностью переведен в шлак. Бура, ее шлаковые производные и шлаковые производные СаО жидкотекучи уже при сравнительно небольших температурах, в то же время как СаО плавится выше 2570 °С. Смесь шлаковую в сочетании с березовым углем рекомендуется применять для защиты от окисления, теплоизоляции, одновременной дегазации (только при прокаленном в вакууме угле), а также ошлакования загрязнений и оксидов при плавке серебряно- и золото-медных, золотосеребряно-медных, серебряно- и золото-цинковых и других сплавов и припоев золота и серебра, не содержащих платины, металлов платиновой группы, никеля и других компонентов, взаимодействующих с углеродом с образованием карбидов или значительно растворяющих его с последующим выделением при кристаллизации, а также фосфора. Может быть применена для плавки серебра и золотосеребряных сплавов, однако при плавке серебра и золотосеребряных сплавов в целях сокращения потерь серебра со шлаками лучше пользоваться одним древесным углем.
Состояние и подготовка древесного угля и буры те же, за исключением того, что размер кусков угля желателен не более 10…15 мм. Состояние и подготовка мела аналогичны подготовке древесного угля. Мел дробят на куски размером не более 20 мм и прокаливают при температуре вишнево-красного цвета в течение 0,1…1,5 часа. Плавленую, дробленую буру и мел смешивают в заданном соотношении и хранят в хорошо просушенной герметичной таре или в подогретом (выше температуры окружающей среды на 20 °С) состоянии.
При загрузке в тигель шихту пересыпают небольшим количеством шлаковой смеси (1 %) и угля (1…2 %), а остальное количество загружают сверху, чтобы после расплавления поверхность расплава была полностью закрыта 20…30 мм слоем защитного покрова, что отвечает его расходу на плавку 2…3 % от массы шихты.
При получении густых комковых шлаков в них добавляют буру, при очень жидких — мел. Перед разливкой расплава избыток шлака сливают в специальную изложницу или тигель для использования при последующих плавках. Остаток шлака на расплаве сгущают, добавляя мел либо сгущенный шлак предыдущих плавок, предварительно измельченный до 10…20 мм. И в том, и в другом случае сгуститель должен быть тщательно прокален перед использованием.
Смесь безводного углекислого натрия и натрия борнокислого в соотношении (1…1,4):1 по массе в прокаленном состоянии. Кальцинированная, т.е. безводная, получаемая прокаливанием сода — белый, легкорастворимый в воде порошок; плотность 2500 кг/м3, температура плавления 856 °С. Теплота образования 269,46 ккал/моль, или 89,82 ккал/г-атом кислорода, свободная энергия 250,59 ккал/моль.
После двойного прокаливания содержит: не менее 98 % Na2СО3, не более 1 % NaCl и 0,1 % Nа2SО4; выход летучих до 4 %. При прокаливании, начиная c 700 °С, диссоциирует тем больше, чем выше нагрев по реакции NaСО3+Q ккал↔Nа2О+СО2↑. При 1000 и особенно 1070°С диссоциация Nа2СО3 становится весьма заметной (давление СО2 достигает соответственно 25 и 35 мм рт. ст.), что создает хорошую дегазацию расплава углекислым газом. Одновременно вследствие малой плотности и сравнительно небольшой температуры плавления оксида натрия последний всплывает на поверхность расплавов, если их температура не ниже 920 °С, смачивает, обволакивает и увлекает в шлак тугоплавкие оксиды и другие твердые включения, очищая расплав.
Если в сплаве присутствуют элементы (Са, Тh, Мg, Li, Ве, Ва, А1, Zr, Ti), более активные к кислороду, чем натрий, оксид натрия будет для них окислителем, причем восстановленный ими по реакции
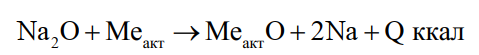 (39)
(39)
металлический натрий будет частично переходить в расплав, а частично улетучиваться в виде пурпурно-красных паров и сгорать по выходе из расплава в атмосфере. Это обстоятельство очень важно для установления возможности и целесообразности применения Nа2СО3 в качестве флюса. Очевидно, что такой флюс применять целесообразно, если указанные элементы находятся в металле (сплаве) в виде примесей, и, наоборот, для сплавов, где эти элементы являются компонентами, его использовать не следует, поскольку бессмысленно переводить в оксиды составляющие сплава, не говоря уже о том, что в этом случае брак плавки неизбежен как по химическому составу сплава, так и по качеству отливаемого из него слитка (загазованность, наличие плен и т.д.).
С большинством других металлов и их оксидами оксид натрия или не реагирует, или реагирует по реакциям аналогично СаО. Например, с оксидом кремния Nа2О образует соединение Nа2SiO3, которое хорошо ошлакуется. Для металлов (Аu, Рt, Ir, Rh и частично Оs), теплота образования оксидов которых менее 23,7 ккал/г-атом кислорода (теплота перехода Na2О в Nа2О2), оксид натрия при отсутствии других, более активных, чем он, к кислороду элементов и соединений является восстановителем, что очень важно для сокращения потерь драгоценных металлов со шлаками. Образующейся диоксид натрия уходит в шлак. Возможность его разложения мало вероятна и большой опасности не представляет, так как образование его ничтожно мало вследствие нахождения в сплавах более активных к кислороду компонентов. При применении Nа2СО3 окисляются активные, наиболее вредные примеси, при одновременном введении буры они интенсивно шлакуются. Кроме того, бура активно реагирует и с Nа2О, связывая ее в более легкоплавкий и в то же время термически устойчивый к разложению шлак.
На этом действии соды и буры и основано совместное их применение в качестве активного флюса для очистки загрязненных отходов драгоценных металлов и сплавов, они как бы дополняют друг друга. Следует, однако, иметь в виду, что применение в качестве флюсующей добавки соды желательно и допустимо только для металлов и сплавов, температура плавления и перегрева которых не более 1300°С. Свыше 1300 °С оксид натрия разлагается с выделением атомарного кислорода, являющегося исключительно сильным окислителем: Na2О+100,7 ккал →2Na+О. При этом окисляются не только примеси, но и компоненты сплава в порядке их сродства к кислороду, в том числе и драгоценные металлы.
Смесь кальцинированной соды и буры рекомендуется применять:
- а) для промежуточных защитно-рафинировочных плавок, загрязненных небольшим количеством примесей (А1, Мg, Si, Zn, Sn, Fе, Мn, Сd, Ni, Со, Sе, Sb, Рb, Вi, Аs, Те и др.), но окисленных шихтовых материалов из золота, серебра и их сплавов с медью и небольшим (до 15 %) количеством платины и палладия;
- б) для рафинировочно-окислительной плавки катодного золота и восстановленного кристаллического серебра, переплавляемых в слитки после аффинажа;
- в) для рафинировочно-защитной переплавки в аноды перед аффинажем пыли от шлифования, содержащую драгоценные металлы, в основном золото и серебро, а также частично платину и палладий.
Смесь следует применять в прокаленном тонкоизмельченном (порошкообразном), тщательно перемешанном в указанном соотношении состоянии. Для плавки катодного золота и восстановленного кристаллического серебра, переплавленных в слитки после аффинажа, составляющие флюсовой смеси можно не прокаливать, поскольку шихту загружают в тигель влажной (в брикетах серебра допускается до 8 % влаги), а влага во флюсе и шихте в данном случае создает условия для окисления вредных примесей и перевод их в шлак. Имеется два варианта применения смеси.
По первому варианту в начале в нагретый до 1000…1100 °С тигель загружают и расплавляют 60…70 % флюсовой смеси. Общий расход ее на плавку от массы шихты: для серебра и его сплавов 25…45 %, для золота и его высокопробных сплавов 15…30 %, для прочих сплавов золота 20…40 % и для шлифовально-наждачной пыли 35…50 %. Затем в несколько приемов, чтобы не охладить флюс, загружают шихтовые материалы и остаток флюсовой смеси. Каждую последующую порцию шихты вводят при поднятии температуры ванны тигля: до 1000 °С для отходов серебра, его высокопробных сплавов, золото-серебряно-медных сплавов и сплавов золота с содержанием меди более 10 %; до 1100 °С для золота, золото-серебряных сплавов, сплавов золота с содержанием меди 10 % и менее, сплавов золота с платиной (не более 15%) и сплавов серебра с платиной и палладием (не более 15 %) и до 1150 °С для сплавов золота с палладием и шлифовальной пыли. После каждой загрузки шихты расплав тщательно промешивают. Расплавы нагревают на 100…120 °С выше указанных температур, но не выше 1280 °С вновь перемешивают, сливают избыток шлака, дают отстояться 2…3 мин и разливают в изложницы. При таком способе достигаются наименьшие потери металлов со шлаками и наименьший угар металлов.
По второму варианту шихту и смесь флюса загружают в разогретый до 1000…1100 °С тигель одновременно и полностью в один прием. Мелкогабаритную шихту тщательно перемешивают с флюсовой смесью до загрузки в тигель, а крупногабаритную обильно пересыпают ею в процессе загрузки. Шихту и флюс плавят и нагревают до тех же температур, перемешивают, разделяют, как указано выше.
Расход флюса такой же, но потери на угар значительно выше вследствие дополнительного окисления металла в процессе нагрева до расплавления флюса. При плавке катодного золота и восстановленного серебра флюс загружают поверх шихты (для золота 3,5…4,0 % и серебра 0,3…0,7 % от ее массы). Золото нагревают до 1220 °С, а серебро до 1100 °С. В обоих случаях металл тщательно перемешивают, дают отстояться и разливают в изложницы.
Смесь калия углекислого с натрием борнокислым в соотношении 1:1 по массе в прокаленном состоянии.
Поташ, т.е. прокаленный углекислый калий, — белый кристаллический порошок; плотность 2290 кг/м3; температура плавления 891°С. Теплота образования 274,03 ккал/моль, или 91,34 ккал/г-атом кислорода. В состоянии поставки I сорт поташа содержит не менее 96 % К2СО3, не более 3,5 % К2SО4, не более 0,2 % солей натрия в пересчете на Nа2О, не более 0,3 % нерастворимого остатка и не более 3 % влаги.
Свойства и поведение поташа при плавке драгоценных металлов и сплавов в присутствии буры аналогичны свойствам и поведению соды, однако выражены слабее: К2СО3 начинает разлагаться при 800°С и диссоциирует на К2О и СО2 при 1000 и 1100 °С вдвое меньше, чем Nа2СО3. К2О имеет сравнительно большую плотность (2780 кг/м3) и высокую температуру плавления, но значительно меньшую, чем Nа2О, подвижность в расплавах металлов и рафинирующую способность. К2О более интенсивный окислитель большого числа элементов, чем Nа2О.
При совместном нагреве К2СО3 с древесным углем образуется взрывчатое вещество К2С2О2, вследствие чего применять К2СО3 совместно с углем недопустимо. В результате таких свойств применение К2СО3 для плавки драгоценных металлов крайне ограниченно.
Смесь калий-натриевого карбоната с натрием борнокислым в соотношении 1:1 по массе в прокаленном состоянии. Свойства и поведение при плавке КNaСО3 аналогичны свойствам и поведению К2СО3 и Na2СО3 и занимают промежуточное положение. Температура плавления значительно ниже.
Смесь соды кальцинированной, натрия борнокислого, углекислого кальция или оксида кальция и березового толченого или активированного угля в соотношении (2:3:1:1) по массе в прокаленном состоянии. Оксид кальция бесцветен, плотность его 3320 кг/м3, температура плавления 2570 °С, теплота образования 151,7 ккал/моль и на 1 г-атом кислорода.
Смесь соды кальцинированной, натрия борнокислого, гидрооксида кальция и березового толченого или активированного угля в соотношении 4:4:1:1. Гашеная известь бесцветна, плотность 2200 кг/м3, теплота образования 236 ккал/моль, или 118 ккал/г-атом кислорода, свободная энергия 214,8 ккал/моль. При нагреве при 580 °С разлагается по реакции
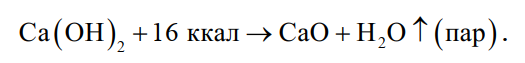
При окислительно-рафинировочных, а не защитно-рафинировочных и особенно нормальных производственных плавках с газонасыщением расплавов водородом до известной степени можно не считаться. В этом случае диссоциация паров воды не вредит, а способствует окислению нежелательных примесей и облегчает перевод их в шлак с помощью, например, буры, оксида кальция и т.д. Окислительно-рафинировочные плавки являются промежуточными, т.е. полученный в результате их металл или сплав в дальнейшем вновь переплавляется в составе шихт производственного назначения, чем достигается при правильном поведении этих плавок дегазация наводороженного металла.
Однако увлекаться окислением примесей рафинировочных плавок парами воды, надеясь, что поглощенный водород будет удален последующей плавкой производственного назначения, не следует, так как выделение водорода из металлов и сплавов сопряжено с большими трудностями и во многих случаях в нужных пределах не достигается. Именно поэтому в составе данной смеси количество гашеной извести и угля совместно и порознь берут крайне ограниченно по сравнению с другими составляющими (в 4 раза меньше, чем буры и соды).
Другая особенность данной смеси — реакция разложения кальцинированной соды в присутствии угля при накаливании: Nа2СО3+2С+241ккал=3СО+2Na — способствует интенсификации рафинирования и дегазации расплавов, но несколько снижает окислительный процесс, так как образующаяся оксид углерода поглощает из системы кислород.
Кроме указанных реакций, при нагреве и плавке драгоценных металлов и сплавов с данной смесью протекают реакции горения, окисления и восстановления, при которых в конечном счете активно окисляются и переходят в шлак в порядке сродства к кислороду и в зависимости от времени примеси почти всех недрагоценных металлов, а также частично и драгоценные компоненты.
Смесь рекомендуется применять для промежуточных окислительно-рафинировочных плавок, повышенно загрязненных примесями (Аl, Мg, Si, Zn, Fе, Мn, Сd, Ni, Со, Sе, Sb, Pb, Вi, Аs, Те и др.) окисленных и не окисленных шихтовых материалов из золота, серебра и их сплавов с медью и небольшим (до 15 %) количеством платины и палладия, а также для промежуточных окислительнорафинировочных плавок, загрязненных небольшим количеством тех же примесей не окисленных шихтовых материалов из тех же металлов и сплавов. Прокаливания составляющих флюсовой смеси в данном случае не производят поскольку флюс содержит гидроксид.
Прочие защитные покровы — хлористый кальций, хлористый натрий, хлористый калий, хлористый барий. Свойства и поведение этих флюсов при плавке и литье драгоценных металлов и сплавов однотипны. Имея очень большие теплоты образования, малую плотность, температуры плавления в пределах 772…925 °С, температуры кипения более 1400 °С и не разлагаясь при этом, эти флюсы механически защищают расплавы драгоценных металлов и сплавов с температурами плавления от 700 до 1300 °С и механически ошлаковывает оксиды недрагоценных металлов.
Данные защитные покровы можно применять для защиты от окисления и механического рафинирования сплавов золота и серебра с медью, никелем, а также палладиево-серебряно-медных сплавов (10…80 % Рd). Однако лучше пользоваться при плавке этих сплавов другими защитно-дегазационными покровами и флюсами. Флюсы предварительно переплавляют (один или лучше два раза), перед использованием прокаливают и хранят в закрытой подогретой таре.
Азотнокислый натрий или азотнокислый калий и натрий борнокислый в соотношении 1:(1…4). По основным свойствам и поведению при нагреве и плавке совместно с драгоценными металлами и их сплавами натриевая и калиевая селитры однотипны и близки: обе бесцветны, кристалличны, легко растворяются в воде; NaNО3 имеет плотность 2250 кг/м3, температуру плавления 308 °С, теплоту образования 111,72 ккал/моль, или 37,2 ккал/г-атом кислорода; в сыром воздухе расплывается; КNО3 имеет плотность 2100 кг/м3, температуру плавления 334 °С, теплоту образования 118,09 ккал/моль, или 39,33 ккал/г-атом кислорода, на воздухе устойчива. При нагреве несколько выше температуры плавления и до более высоких температур, соответствующих температурам плавления золота, серебра и их сплавов, селитры энергично разлагаются по цепным реакциям
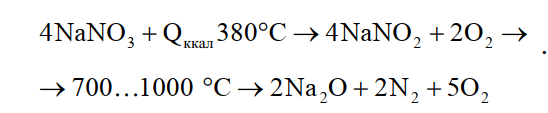 (40)
(40)
Образующийся кислород взаимодействует с элементами шихты и переводит их в оксиды. Если в шихте присутствуют компоненты с большим сродством к кислороду, чем у натрия или калия, возможны дополнительные реакции окисления этих компонентов оксидами натрия или калия. В присутствии угля или угля и серы нельзя применять для плавки КNО3 вследствие образования взрывчатых веществ. Опыты показывают, что при окислительно-рафинировочных плавках с селитрами и бурой загрязненных золото- и серебряно-медных и никелевых шихт, кроме примесей (Zn, Сd, Fе и др.), которые полностью окисляются и ошлаковываются, заметно окисляются и переходят в шлак медь и никель, а также частично серебро и золото. За счет этого проба сплавов повышается на 10…20 единиц, например сплава ЗлСрМ583-80 до 590…600 проб; в шлак при этом переходит до 0,13% золота и 0,95 % серебра от содержания в шихте. Не следует злоупотреблять количеством селитры. В любом случае нужно сильно загрязненные отходы перерабатывать аффинажем, так как потери драгоценных металлов при аффинаже в сравнении с окислительнораффинировочными плавками значительно меньше.
Натриевую и калиевую селитры рекомендуется применять для окислительно-рафинировочных плавок, сильно загрязненных примесями (Аl, Мg, Si, Zn, Sn, Fе, Мn, Сd, Ni, Со, Sе, Sb, Рb, Вi, Аs, Те и др.) не окисленных и окисленных шихтовых материалов из золота, серебра и их сплавов с медью, никелем и небольшим количеством (до 15%) платины и палладия, а также для окислительно-рафинировочных плавок катодного золота после аффинажа. В присутствии угля, а также угля и серы применять калиевую селитру нельзя, так как при их совместном взаимодействии образуются взрывчатые смеси.
Составляющие флюса следует тщательно просушивать и прокаливать при 150…200 °С в течение 1…1,5 час.
Количество флюса на плавку берут в зависимости от степени загрязнения шихты: селитры 1…2 %, буры 0,5…2 % от массы шихты. Шихту расплавляют под покровом буры; при достижении нижнего предела температуры расплава в нее вводят в два-три приема селитру. Расплав тщательно перемешивают, дают отстояться, освобождают от излишка шлака, вновь перемешивают, дают выстояться и разливают в изложницы. Температура перегрева расплавов не должна превышать 100 °С, ее все время следует поддерживать на нижнем пределе.
Воздух или кислород газообразные — сильные окислители металлов, особенно недрагоценных в расплавленном состоянии. Воздух и кислород рекомендуется применять для окислительнорафинировочных плавок тех же металлов и сплавов. Их подают в расплавы через керамические трубки под избыточным давлением в течение 0,5…3 мин. в зависимости от количества подлежащих ошлакованию примесей.
3. Раскислители
Медь фосфористая марок МФ1 или МФ2 — один из лучших раскислителей для сплавов драгоценных металлов, содержащих медь и другие недрагоценные компоненты с меньшим сродством к кислороду, чем фосфор. Согласно диаграмме состояния сплавов Сu-Р, марки МФ1 и МФ2 отвечают заэвтектическому составу (Сu3Р+α) с температурами конца плавления 707 °С и начала плавления от 730 (при содержании фосфора 8,5 %) до 850°С (при содержании фосфора 10 %). В этом интервале эвтектика полностью переходит в Сu3Р, а выше его в однородный расплав меди и фосфора. При введении фосфористой меди в расплавы драгоценных металлов, содержащих оксиды меди, протекают следующие реакции:
![]() (41)
(41)
![]() (42)
(42)
или
![]() (43)
(43)
Образуются парообразный фосфорный ангидрид Р2О5 (температура возгонки 347 °С), жидкая фосфористая соль СuРО3 (температура плавления 707 °С), а также восстановленная до металла медь.
Аналогично реагирует фосфористая медь в сплавах драгоценных металлов и с оксидами других компонентов, имеющих меньшее сродство к кислороду, чем фосфор (Sn, Сd, Co, Со, Рb), а также с оксидами примесей (Fе, Gе, Мо, Вi, Те, Тl и др.), если они не ошлакованы и не выведены из расплавов в процессе плавки. Однако реакции протекают менее активно ввиду большего сродства к кислороду этих компонентов, чем меди.
При раскислении сплавов драгоценных металлов фосфористой медью (фосфором) с точки зрения механических и литейных свойств сплавов не следует опасаться излишнего ввода раскислителя, так как фосфор в довольно широких пределах не ухудшает, а улучшает механические и литейные свойства. Однако не следует увлекаться и излишним вводом фосфора против расчетных количеств. Могут образоваться легкоплавкие эвтектики (например, в серебряно-медных сплавах может образоваться тройная с температурой плавления 646°С), которые располагаются по границам зерен сплавов при их затвердевании и существенно снижают жаростойкость. В дальнейшем такие эвтектики могут привести к пережогу полуфабрикатов и изделий при отжиге. Поэтому в случае ввода в сплавы драгоценных металлов избыточного количества фосфора следует проводить термическую обработку полуфабрикатов и изделий при температуре несколько ниже температур плавления указанных фосфорсодержащих эвтектик.
Исключительно осторожно следует подходить к определению количества фосфора для раскисления сплавов, предназначенных для электротехнических целей, так как даже небольшое остаточное содержание фосфора в драгоценных металлах и сплавах существенно снижает их электропроводность. Поэтому сплавы для электротехнических целей нужно несколько недораскислять (вводить фосфор менее требуемого на раскисление количества), чем иметь излишки этого раскислителя или лучше пользоваться другими раскислителями.
Существенную роль при раскислении фосфористой медью играет время раскисления и порядок ввода раскислителя в шихту и расплав, так как при недостатке времени цель применения раскислителя не достигается и в верхних частях слитка могут образовываться скопления метафосфата, не успевшего выйти из расплава. Поэтому после раскисления расплаву необходимо время для отстоя (обычно 2…3 мин).
Фосфористая медь рекомендуется для раскисления при плавке сплавов и припоев драгоценных металлов, содержащих медь и наряду с медью никель, олово, кадмий и другие компоненты с меньшим сродством к кислороду, чем фосфор. Особенно желательно применять фосфористую медь для раскисления серебряно-медных, золотосеребряно-медных, платино-медных, палладий-медных, серебряномедно-никелевых, палладий-серебряно-медных и золото-никелемедных сплавов, а также серебряно-медных, серебряно-меднооловянных, серебряно-медно-никелевых и золото-серебряно-меднокадмиевых припоев.
Допустимо и желательно применять фосфористую медь также при приготовлении сплавов драгоценных металлов, в состав которых наряду с медью входят компоненты, более активные к кислороду, чем фосфор (Ве, Si, Мn, Zn, In и др.). Однако в этих случаях раскислитель можно применить только до ввода в расплавы более активных компонентов.
Фосфористую медь вводят в плавку хорошо просушенной, дробленной или в виде порошка для удобства взвешивания и лучшего взаимодействия в расплаве. Хранить до использования следует в подогретом выше температуры окружающей среды на 20…50 °C состоянии.
Вводить фосфористую медь рекомендуется в два приема: первый раз 75 % при загрузке или лучше при расплавлении шихты и второй раз — остальные 25 % перед разливкой расплава. Фосфористую медь нужно вводить в расплав с помощью графитового колокольчика и по возможности глубже.
Во всех случаях после ввода раскислителя расплав следует тщательно перемешать, после чего дать ему выстояться не менее 2…5 минут и лишь затем приступать к разливке.
Литий металлический или в виде сплавов с медью. Плотность лития 590 кг/м3. Температура плавления 186 и кипения 1400 °С. На воздухе быстро окисляется, при комнатной температуре разлагает воду. При хранении должен быть изолирован от воздуха и влаги. Теплота образования оксида лития 142,8 ккал/моль или 142,8 ккал/г-атом кислорода. Оксид лития имеет плотность 2013 кг/м3 и температуру плавления 1700 °С.
Температура начала плавления сплавов лития с медью 179 °С и температура конца плавления 186…183 °С.
Обладая большим сродством к кислороду, литий является одним из самых активных и быстродействующих раскислителей и дегазаторов водорода для драгоценных металлов и их сплавов. Однако оксиды лития значительно труднее удалять из расплавов, чем оксиды фосфора, так как оксиды фосфора газообразны, а оксиды лития твердые в чрезвычайно дисперсном состоянии в виде ветвистых образований, понижающих вязкость расплавов. В связи с этим применять литий для раскисления сильно окисленных шихт нежелательно, лучше пользоваться фосфористой медью. При отсутствии в расплавах водорода литий реагирует с оксидами почти всех элементов (кроме СаО, ТhО2 и МgО) с образованием твердого оксида лития, всплывающего на поверхность ванны и переходящего в шлак, а также с восстановлением оксидов менее активных металлов (оксиды всех драгоценных металлов, меди, свинца, кобальта, никеля, кадмия, олова и цинка) до металлов в порядке теплоты их образования. При содержании в расплавах наряду с кислородом водорода происходят одновременно раскисление и дегазация, причем вследствие образования гидрата оксида лития раскислитель используется с большей эффективностью.
Гидрат оксида лития имеет температуру плавления 445 °С и малую плотность, поэтому из драгоценных металлов и сплавов он всплывает в виде шарообразных включений. Если после раскисления металлу не дать отстояться, то включения гидрата оксида лития остаются в металле в виде эмульсии, что сильно сказывается на коррозионной стойкости сплавов и снижает другие качественные характеристики полуфабрикатов.
Оставшийся в расплаве литий мало влияет на точку ликвидуса сплавов, но значительно изменяют точку солидуса. Например, точка солидуса сплава СрМ835 снижается в присутствии 0,1 % лития на 7°С (с 778 до 771 °С), в присутствии 0,4 % лития на 23 °С (до 755 °С) и в присутствии 1,0 % лития на 66 °С (до 712 °С). Поэтому сплавы, содержащие литий, очень чувствительны к перегреву. Однако содержание лития в сплавах СрМ875 и др. до 0,4 % при 650…720 °С еще не вызывает красноломкости. С присадкой лития зерно сплава становится грубее. В целом же присадка лития в сплавы драгоценных металлов, особенно серебра с медью, не ухудшает механических свойств и химической стойкости.
Раскисление литием применяют в тех случаях, когда металлы или сплавы предназначаются для электротехнических целей, так как в большинстве их литий практически не переходит в твердый раствор и не снижает электропроводность в отличие от фосфора.
При раскислении литием следует считаться с тем, что при недостаточном времени раскисления оксиды лития могут не успеть всплыть на поверхность расплава и образовать в той или иной (обычно верхней) части слитка скопления в виде отдельных гнезд. Поэтому не следует после раскисления сразу же заливать металл в изложницу, а необходимо дать ему выстояться в течение 2…3 мин.
Механизм раскисления медно-литиевым сплавом аналогичен раскислению литием. Однако применяют этот раскислитель ввиду присутствия в нем меди только для сплавов, содержащих медь.
Литий металлический рекомендуется применять для раскисления и дегазации от водорода: серебра, серебряно-медных, золотомедных, золото-серебряно-медных и других сплавов, а также припоев на основе золота и серебра из не окисленных или слабо окисленных шихт.
Медно-литиевый сплав рекомендуется применять для тех же целей, исключая серебро, золотосеребряные и другие сплавы и припои, не содержащие меди.
Количество раскислителя на плавку берут в зависимости от характера расплава: для серебра и золотосеребряных сплавов 0,01 % от массы шихты, для прочих сплавов — от 0,1 до 0,4 % от массы шихты в зависимости от содержания в ней меди и других недрагоценных компонентов, и степени ее окисленности. Например, для нормальных производственных плавок не окисленных или слабо окисленных серебряно-медных сплавов с содержанием серебра 92,5…87,5 % — практически достаточно для раскисления 0,1 % лития, а для сплава с 50,0% — 0,2…0,25 % лития. Литий вводят в расплав за 3…5 мин до разливки посредством графитового колокольчика и по возможности на большую глубину расплава, после чего тщательно перемешивают в течение 1…2 мин, затем дают отстояться 2…3 мин и разливают по изложницам.
Литий следует хранить изолированно от воздуха и влаги под слоем керосина или бензина прижатым (так как он всплывает).
Прочие раскислители: цинк чушковый марок ЦВ, Ц0 и Ц1, кадмий чушковый в литых шариковых анодах марок Кд0 и Кд1 (по ГОСТ 1467-93) или медно-кадмиевая лигатура марки ЛМКд-28.
Свойства и поведение данных раскислителей при плавке аналогичны. Плотность цинка 7140 кг/м3, температура плавления 419,4, кипения 907 °С. Плотность кадмия 8650 кг/м3, температура плавления 320,9, кипения 767 °С. Оба металла серебристого цвета. По отношению к кислороду более активен цинк. Теплота образования оксида цинка 83,3, а оксида кадмия 65,2 ккал/моль. Продукты раскисления расплавов цинком и кадмием, как и других металлических раскислителей, твердые оксиды с высокой температурой плавления (для ZnО 1800°С, для СdО данных нет). К тому же они имеют сравнительно большую плотность (ZnО — 5600, а СdО — 8150 кг/м3). Оксиды цинка и кадмия получаются в чрезвычайно дисперсном состоянии в виде ветвистых образований, что существенно понижает вязкость расплавов и создает большие трудности для удаления этих оксидов из расплавов. Однако этот недостаток частично нивелируется за счет присущего цинку и особенно кадмию эффекта возгонки (испарения) при уже сравнительно небольших температурах, что создает, особенно для кадмия, хорошую дегазацию расплава и одновременный вынос оксидов металлов на поверхность ванны. Вследствие этого для целей раскисления более подходит кадмий, чем цинк.
Процесс раскисления цинком и кадмием требует значительного времени для ошлакования оксидов, поэтому их как специальные раскислители перед разливкой расплавов практически не применяют. Раскисление сплавов драгоценных металлов цинком и кадмием в основном сводится к применению их одновременно как компонентов шихты. При этом желательно во всех случаях при расплавлении более тугоплавких компонентов, особенно если шихта сильно окислена, вводить в нее и расплав (но до введения в него цинка или кадмия) другой эффективный раскислитель и лишь затем цинк, кадмий или лигатуры и отходы, содержащие их.
Цинк и кадмий рекомендуется применять в основном для раскисления сплавов и припоев золота и серебра, содержащих цинк и кадмий в качестве компонентов. Кроме того, кадмий можно применять как специально вводимый раскислитель в сплавы драгоценных металлов, содержащих никель и медь, в частности в сплавах палладия с серебром, медью и никелем ПдСрН-13-2 и ПдСрМ-13-2.
Раскислители вводят в расплавы более тугоплавких компонентов, согласно расчету шихты. Металлический цинк или кадмий следует вводить в расплавы посредством графитового колокольчика. Перед вводом цинка и кадмия в расплав, особенно сильноокисленных шихт, расплавы из более тугоплавких компонентов необходимо раскислять фосфористой медью, после этого вводить в него цинк и кадмий.
Если кадмий применяется как специальный раскислитель в сплавы, где он не является компонентом, количество его должно быть минимальным. При этом применение раскислителя — меди фосфористой также желательно, как и в случае приготовления сплавов и припоев, содержащих кадмий в качестве компонента. Порядок ввода фосфористой меди тот же. Кадмий же следует вводить в расплав перед разливкой не позднее чем за 3…5 мин. Для сплавов ПдСрМ-13-2 и ПдСрН-13-2 количество вводимого в качестве раскислителя кадмия должно составлять 0,05 % от массы шихты. После ввода цинка или кадмия расплавы следует тщательно промешать и дать им выстояться для ошлакования остатков оксидов.
