Содержание страницы
1. Аффинаж драгоценных металлов
Аффинаж — очистка драгоценных металлов от примесей и отделение их друг от друга. На аффинаж поступают черновые металлы в слитках, концентраты гравитационного передела, осадки цианистого процесса, шламы электролитического рафинирования меди и никеля, шлифовое золото после амальгамации, а также отходы производства и потребления.
Для плавки применяют графито-шамотные или графитовые с наклонной осью газовые или электрические печи. Тигли должны быть жаростойкие (1300…1500 °С), термически и химически стойкие по отношению к расплаву и особенно к применяемым флюсам. Шламы от электролиза меди и металлы со свинцовых заводов имеют преимущественно серебряно-золотой состав, с соотношением серебра к золоту 6…8. В сплавах из цианистых осадков и после амальгамации преобладает золото.
В результате металлургической переработки полиметаллических руд драгоценные металлы переходят в черновые металлы — никель и медь. Платиновые металлы собираются почти полностью в черновой никель, a Ag и Аu — в черновую медь. При последующем электролитическом рафинировании черновых металлов Ag, Au и платиновые металлы осаждаются на дне электролитической ванны в виде шлама, который отправляют на аффинаж.
При аффинаже сплавов, содержащих менее 30 % или более 70 % золота, перерабатывают раздельно. В большинстве случаев, золотосеребряные сплавы, поступающие на аффинаж содержат также платину и МПГ.
Наиболее древними из методов аффинажа являются пирометаллургические, которые эволюционировали от простого расплавления руды на кострах до индукционной и плазменной плавки.
Возможно, что купелирование (отделение благородных металлов от свинца окислительным плавлением в пламенных печах при ~1000 °С), использовавшееся на заре металлургии драгоценных металлов для разделения серебра и свинца, является прародителем всех окислительных процессов рафинирования.
История возникновения основных методов аффинажа золота и серебра в сжатом виде представлена в табл. 1.
Современное аффинажное производство золота характеризуется высоким уровнем применения электролиза (88 % заводов) и внедрением жидкостной экстракции (12 %). В качестве стандартных операций в технологии аффинажа используют процесс Миллера (40 %), гидрохлорирование (54 %), кислотный аффинаж (46 %) и купелирование (22 %).
Таблица 1 – Хронология возникновения методов аффинажа золота
| Метод | Начало применения, год | Метод | Начало применения, год |
| Разделение Au и Ag
при обжиге с:
|
100 до н.э. 1150…1200 1300…1400 1556 1738 |
Аффинаж электролизом: | |
|
1884 | ||
|
1898 | ||
| Водная хлоринация | 1833 | ||
| Плавка: | |||
|
3500 до н.э. | ||
|
XIX век | ||
| Купелирование | 1400 до н.э. | ||
| Кислотный аффинаж | 1400…1600 |
|
1920…1940 |
| Высокотемпературная хлоринация
(процесс Миллера) |
1867 |
|
1970 |
Сырьем аффинажных заводов служат золотосеребряные сплавы (сплавы Доре), шламы и осадки, насыщенные активные угли, бытовой и промышленный лом, монеты, отходы стоматологии, электронный лом и др. Таким образом, можно еще раз подчеркнуть, что в настоящее время стирается грань между предприятиями вторичной металлургии и аффинажными заводами – это во многом определяется борьбой за источники сырья.
Современные аффинажные производства являются по существу комбинатами, перерабатывающими многочисленные виды сырья и выпускающими, помимо слитков, заготовки и готовые изделия для ювелирной и стоматологической промышленности, электроники и электротехники; ряд заводов специализируется на изготовлении декоративных изделий, монет, памятных медалей и др.
На рис. 1-4 приведены блок-схемы, характеризующие различные способы аффинажного производства золота. Выбор конкретного способа зависит от многих факторов: состава и качества исходного сырья, вида примесей, существующей инфраструктуры, экологических и финансовых соображений. Часто существенный вклад в себестоимость золота вносят вспомогательные операции, прямо не участвующие в технологии аффинажа.
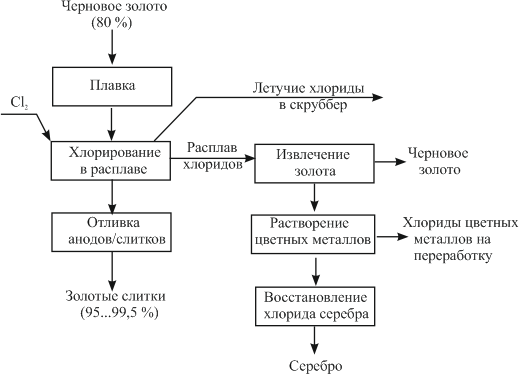
Рисунок 1 – Принципиальная схема процесса Миллера
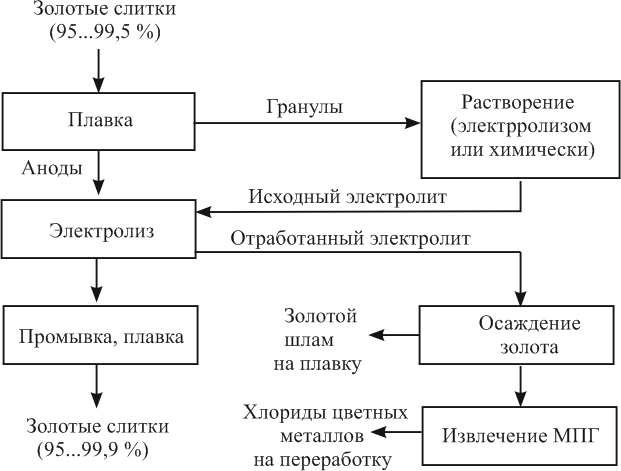
Рисунок 2 – Принципиальная схема аффинажа золота электролизом
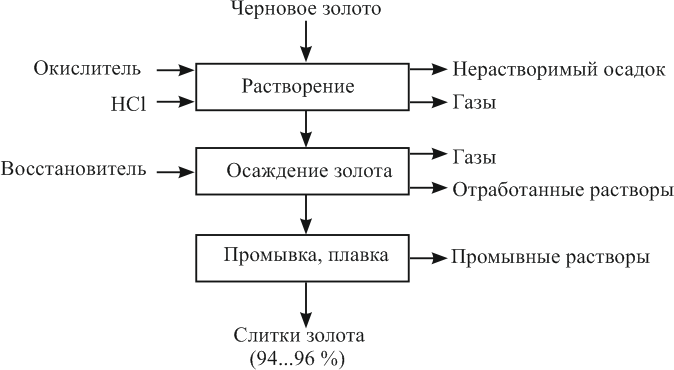
Рисунок 3 – Принципиальная схема аффинажа золота способом растворение-осаждение
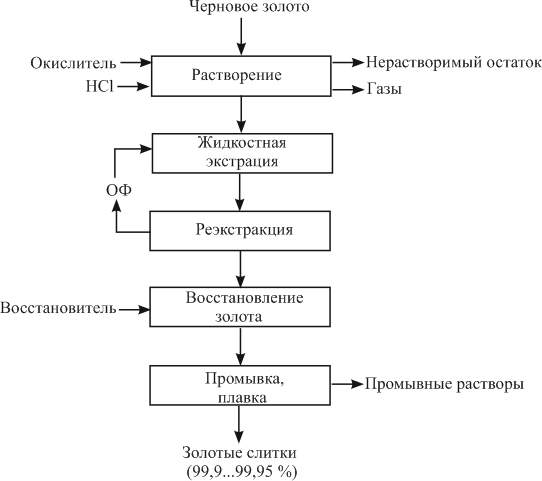
Рисунок 4 – Принципиальная схема аффинажа золота способом растворение — жидкостная экстракция
В табл. 2 приведены показатели, характеризующие аффинажные процессы, откуда видна важность характеристик исходного материала. Хлоринация в ее двух видах не лимитируется содержанием серебра или формой, в которой находится исходный материал, в то время как содержание золота в анодах при электролизе должно быть достаточно высоким. Кроме того, при аффинаже электролизом исходный материал отливают в виде анодов или гранул (для получения электролита). Процесс растворения лимитируется содержанием серебра и достаточно развитой поверхностью частиц для увеличения скорости растворения.
При хлоринации перевод золота в водную, хлоридную или газовую фазы заканчивается в считанные часы, однако переработка различных полупродуктов растягивает общее время процесса до 1…2 суток.
Таблица 2 – Сравнительные характеристики аффинажных процессов
| Процесс | Ограничение по
составу сырья |
Физическая
форма сырья |
Время,
сут. |
Периодичность
процесса |
Влияние на
окружающую среду |
| Хлоринация | 20% золота.
Ограничений по содержанию серебра нет |
Без ограничений | 1…2 | Нет | Нужны газовые
поглотители |
| Электролиз | > 85 % золота | Аноды
или гранулы |
3…4 | Нет | Используется
минимум растворов |
| Растворение (осаждение) | <15 %
серебра |
Дискретные частицы | 2…3 | Да | Нужны газовые
поглотители; раствор используется один раз |
| Растворение
(жидкостная экстракция) |
<15 %
серебра |
Дискретные частицы | 2…4 | Возможна | Нужна очистка газов;
раствор используется один раз; нужна очистка от органических соединений. |
Электрорафинирование требует определенного количества времени для изготовления анодов и получения электролита. Когда это время складывается со временем, необходимым для замены анодов, переработки их остатков и отработанного электролита, общий итог укладывается в трое-четверо суток. В случае использования жидкостной экстракции существенное влияние оказывает время нахождения золота в составе органической фазы. Практика действующих производств указывает на то, что в общее время процесса свой вклад могут внести причины чисто организационного характера. С точки зрения выпуска готовой продукции все аффинажные процессы являются периодическими.
Печь в процессе Миллера останавливают для разливки, когда необходимая степень чистоты золота достигнута, в процессе Вольвилля катоды извлекают раз в сутки, а растворение золота проводят в одном реакторе, в то время как в другом его осаждают. Однако в процессе Миллера обычно не перерабатывают образующиеся хлориды (их непрерывно снимают), а также выделяющиеся газы, поступающие в скруббер; при электролизе электролит используется многократно, аноды также заменяют по мере их растворения. С этой точки зрения, рассматриваемые процессы не являются периодическими, что создает предпосылки для их автоматизации.
1.1 Аффинаж золота и серебра
Состав золото-серебросодержащего сырья очень сложен и непостоянен. В них, кроме золота, могут присутствовать серебро, медь, свинец, сурьма, мышьяк, олово, висмут и другие примеси, а в ряде случаев и металлы платиновой группы. Примеси недрагоценных металлов в сплавах называют лигатурой. Содержание примесей колеблется в очень широких пределах — от долей до 60 %. Для усреднения поставленной партии сырья, с целью получения достоверной информации при их опробовании, проводят приемную плавку.
Известно несколько методов аффинажа золота и серебра:
- хлорный процесс;
- электрохимическое рафинирование;
- кислотные методы аффинажа.
- Наибольшее распространение получили хлорный процесс и электрохимическое рафинирование.
Процесс аффинажа проводят на специализированных аффинажных заводах или в специальных цехах металлургических предприятий.
Приемная плавка. Поступающие на аффинажный завод материалы подвергают приемной плавке для усреднения и опробования отдельных партий сырья. Ее ведут в графитовых тиглях в электрических индукционных печах. На крупных аффинажных заводах применяют печи мощностью до 250 кВт с вместимостью тигля до 280 кг золота.
Для сведения к минимуму потерь драгоценных металлов за счет улетучивания плавку ведут под слоем шлака, используя в качестве флюса соду и буру (1,5…3,0 % от массы загруженного металла). С этой же целью избегают излишнего перегрева металла. Плавку золотосеребряных сплавов проводят при 1150…1200 °С, серебра – при 1040…1060 °С.
При содержании серебра более 90 %, расплав при застывании склонен к разбрызгиванию вследствие выделения поглощенного кислорода, поэтому его плавят под слоем древесного угля или газовой восстановительной атмосфере. В процессе разливки струя и изложница должны находиться в пламени горелок, создающих восстановительную атмосферу. В зависимости от применяемого метода аффинажа расплавленный металл разливают в слитки, идущие на аффинаж хлорированием, или в аноды, поступающие на электролитическое рафинирование.
Поступающие на аффинаж золотосеребряные сплавы вследствие содержания в них цинка, свинца, меди и других примесей, а также металлов платиновой группы, подвержены ликвации, что затрудняет их опробование. Во избежание возможных ошибок пробу металла отбирают непосредственно из печи, где расплав хорошо перемешивается токами высокой частоты.
Отобранную пробу отливают в изложницу в виде тонкого слитка. Быстрое охлаждение такого слитка обеспечивает достаточную однородность сплава. Пробу для анализа отбирают в виде стружки или опилок. Результаты анализа необходимы для точного учета количества драгоценных металлов, поступивших на аффинаж, и расчета с поставщиками.
Хлорный процесс. Для отделения лигатуры и большей части серебра исходные расплавы продувают в таких же печах хлором с переводом хлоридов в наведенный шлак или в возгоны. После удаления из сплава лигатурных примесей и серебра золотой расплав, содержащий до 99,7 % золота, разливают в слитки и в случае необходимости подвергают электрохимическому рафинированию. Шлаки и другие отходы процесса хлорирования для извлечения серебра требуют сложной гидрометаллургической переработки, из-за чего такой способ аффинажа в настоящее время применяют редко.
Хлорный процесс основан на том, что не драгоценные металлы и серебро окисляются газообразным хлором значительно легче, чем золото. Сущность этого метода заключается в продувании хлора через расплавленное черновое золото. Хлор в первую очередь взаимодействует с не драгоценными металлами и серебром, золото и металлы платиновой группы реагируют с хлором в последнюю очередь. Образующиеся расплавленные хлориды недрагоценных металлов и серебра не растворяются в металлическом золоте и, имея меньшую плотность, всплывают на поверхность. Часть хлоридов недрагоценных металлов улетучивается. Хлорный процесс широко применяют в ЮАР. Металл, поступающий на аффинаж, содержит 88…90 % Аu и 7…11 % Ag. Основные примеси: медь, свинец, железо, цинк.
Процесс ведут в индукционных тигельных печах с корундовой (графитовой) футеровкой. Черновой металл, прошедший приемную плавку, в виде слитков загружают в тигельную печь вместимостью до 500 кг по золоту. Для образования шлака в тигель вовремя плавки загружают небольшое количество смеси буры, кварца и хлористого натрия. Образующийся тонкий слой шлака уменьшает улетучивание металла и предохраняет стенки тигля от разъедания. После расплавления металла через крышку тигля в расплав вводят одну или две фарфоровые трубки, по которым подают газообразный хлор. Для лучшего диспергирования хлора в расплав в стенках трубки (погруженную в расплав) сделаны отверстия. Процесс ведут при температуре 1150 °С.
Первыми хлорируются железо, цинк, свинец. Низкокипящие хлориды железа и цинка переходят в газовую фазу. Хлорид свинца частично улетучивается, частично всплывает на поверхность металла. Улетучивание хлоридов вызывает интенсивное бурление расплава, поэтому подачу хлора в этот период ведут малыми дозами.
Медь и серебро начинают реагировать с хлором лишь после того, как прореагирует с хлором основная масса железа, цинка и свинца. Температура кипения AgCl и CuCl выше температуры ведения процесса, поэтому хлориды серебра и меди остаются в тигле, образуя на поверхности расплава золота слой расплавленных хлоридов. Ввиду того, что хлориды не улетучиваются, подачу хлора в этот период можно увеличить, не опасаясь разбрызгивания расплава.
Накапливающиеся на поверхности металла расплавленные хлориды, а также шлак периодически удаляют из тигля и загружают новую порцию флюса. К концу процесса абсорбция хлора расплавом замедляется, поэтому подачу хлора уменьшают. Конец процесса определяют по появлению желтого налета золота на трубках, подводящих хлор, и по появлению над расплавом красного дыма, окраска которого объясняется присутствием в нем хлорида золота. По окончании хлорирования с поверхности металла удаляют остатки хлоридов и шлака, очищенное золото переводят в миксер и разливают в слитки. Смесь хлоридов и шлака, полученная в результате хлорирования чернового золота, содержит значительное количество запутавшихся в них корольков золота. Для извлечения золота ее плавят в тиглях при температуре 1100 °С. Расплав расслаивается на шлак (сверху) и слой хлоридов (снизу). На поверхность расплава отдельными небольшими порциями загружают соду, при этом часть серебра восстанавливается
![]() (1)
(1)
и, опускаясь в виде мелких капель на дно тигля, увлекает большую часть золота, находящегося в хлоридах.
Общее количество вводимой соды составляет около 4 % массы хлоридов, при этом восстанавливается примерно пятая часть содержащегося в хлоридах серебра, что обеспечивает высокую степень извлечения золота. Полученный серебряно-золотой сплав снова поступает на хлорирование вместе с новой партией золота. Обеззолоченные хлориды служат сырьем для получения серебра. Они содержат до 70 % хлорида серебра, остальное — хлориды меди, натрия, свинца. Переработка хлоридов может осуществляться различными методами.
По одному из них хлориды дробят до крупности 25 мм и многократно обрабатывают во вращающихся бочках горячим 5 % раствором NaСl, подкисленным соляной кислотой. Хлориды натрия и свинца переходят в раствор; присутствие в растворе ионов Сl— способствует выщелачиванию мало растворимого в воде хлорида СuСl
![]() (2)
(2)
Остающийся в нерастворимом остатке хлорид серебра восстанавливают до металла с помощью металлического железа или цинка
![]() (3)
(3)
По другому методу расплавленные хлориды гранулируют, выливая их в воду. Полученные мелкие гранулы (≤ 2 мм) обрабатывают водным раствором хлората натрия NaClO3 в присутствии НСl. При этом мало растворимый в воде хлорид СuСl окисляется до хорошо растворимого СuСl2
![]() (4)
(4)
что резко интенсифицирует процесс обезмеживания. Одновременно выщелачиваются хлориды натрия и свинца. Очищенный хлорид серебра восстанавливают до металла цинковым порошком.
Губчатое серебро после промывки и сушки переплавляют в аноды для дальнейшего электрохимического рафинирования. Содержание золота в анодах – 99,8…99,9 %. Процесс аффинажа хлорированием проще и дешевле электрохимического процесса и пригоден для рафинирования золота любой чистоты, но дает недостаточно чистое золото (обычно 99,5…99,6 %). Такой металл годится для использования в монетарных целях, но не удовлетворяет требованиям современной техники, когда требуется содержание золота ≥ 99,99. К недостаткам хлорного метода аффинажа следует также отнести существенные потери серебра и платиновых металлов (если они присутствуют в исходном металле), которые остаются в очищенном золоте.
Наиболее совершенным методом аффинажа золота и серебра является электрохимическое рафинирование.
Электрохимические методы аффинажа наиболее эффективны и позволяют получать металлы высокой чистоты при комплексном использовании всех ценных компонентов, входящих в состав рафинируемого металла.
При этом сплавы, содержащие более 80 % или менее 20 % золота, перерабатывают раздельно по различным технологиям. Аффинаж сплавов с преобладающим содержанием серебра (менее 20 % золота) требует двухстадийного электролиза: сначала при анодном растворении сплава на катоде осаждают чистое серебро, а золото переводят в шлам. Затем полученный шлам плавят и вновь подвергают электролизу с осаждением на катоде чистого золота.
При электролитическом рафинировании серебра в качестве растворимого анода используют рафинируемый серебряный сплав. Катодную основу делают из листового серебра, алюминия, титана или коррозионной стали. Электролитом служит водный раствор азотнокислого серебра с добавкой небольшого количества азотной кислоты. Схематически процесс можно представить следующим образом:
Ag(Al,Ti) (катод) │AgNO3, HNO3, Н2О, примеси Ag с примесями (анод).
При электрохимическом растворении анода серебро переходит в раствор ( ![]() )
)
![]() (5)
(5)
Примеси с более положительным потенциалом (золото, платина, палладий) выпадают в осадок (шлам). Выделение кислорода на аноде практически невозможно, так как нормальный потенциал кислорода в кислом растворе
![]() (6)
(6)
значительно положительнее потенциала серебра. Примеси с потенциалом более отрицательным, чем потенциал серебра — медь, свинец, висмут, цинк, железо и др., переходят в раствор.
Основным процессом на катоде является восстановление ионов серебра
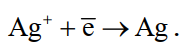 (7)
(7)
Серебро является одним из наиболее электроположительных металлов. Скорость разряда ионов серебра весьма велика. Поэтому даже при высоких плотностях тока разряд подавляющего большинства примесей на катоде практически исключен. Так, выделение водорода на катоде
![]() (8)
(8)
теоретически возможно лишь при чрезвычайно низких концентрациях серебра в электролите, никогда не реализуемых на практике.
Одно из немногих исключений составляют ионы частично восстанавливаются на катоде NO3— , которые
![]() (9)
(9)
![]() (10)
(10)
![]() (11)
(11)
С повышением кислотности электролита возрастают потенциалы и скорость этих реакций. Однако при нормальном ведении процесса скорость разряда анионов NO- остается все же небольшой и снижение катодного выхода по току, обусловленное протеканием этих процессов, сравнительно невелико. Таким образом, основным катодным процессом является восстановление катионов серебра.
В состав электролита, применяемого при электрохимическом рафинировании серебра, всегда входит свободная азотная кислота. Присутствие кислоты увеличивает электропроводность электролита и, соответственно, уменьшает расход электроэнергии. Вместе с тем, чрезмерно высокая концентрация азотной кислоты нежелательна, так
как при этом ускоряется процесс химического растворения катодного серебра, и получают существенное развитие процессы катодного восстановления анионов NO- . Это ведет к уменьшению катодного выхода по току, повышению расхода азотной кислоты, к ухудшению условий труда в результате загрязнения атмосферы цеха выделяющимися оксидами азота. При повышенной концентрации азотной кислоты значительно увеличивается переход в раствор палладия и платины, а также их осаждение на катоде совместно с серебром. С учетом этого концентрацию азотной кислоты в электролите поддерживают не выше 20 г/л. Иногда в состав электролита для повышения его электропроводности вводят азотнокислый калий (до 15 г/л).
В анодах, помимо серебра, в качестве примесей всегда содержатся золото, металлы платиновой группы и недрагоценные металлы — медь, свинец, висмут, цинк, железо и т.д. В серебряно-золотых сплавах, получаемых при переработке медеэлектролитных шламов, присутствуют селен и теллур. Содержание этих примесей и их поведение при электролизе в значительной степени определяются условиями электролитического рафинирования серебра.
Содержание в анодном металле до 20 % Аu не нарушает течение электролиза. Золото имеет стандартный потенциал ( ![]() ), более положительный по сравнению с серебром и поэтому оно не растворяется на аноде, а переходит в шлам. При содержании выше 20% золото образует плотную корку на аноде, пассивирует его и вызывает побочные реакции на электродах.
), более положительный по сравнению с серебром и поэтому оно не растворяется на аноде, а переходит в шлам. При содержании выше 20% золото образует плотную корку на аноде, пассивирует его и вызывает побочные реакции на электродах.
Нормальный потенциал палладия
![]()
Довольно близок к потенциалу серебра. Поэтому палладий частично растворяется на аноде и при накоплении его в электролите осаждается на катоде вместе с серебром. Во избежание протекания этого процесса при наличии в анодном металле палладия электролиз ведут при минимальной кислотности электролита и пониженной плотности тока (300…400 А/м2) и тщательно контролируют состав электролита, не допуская содержания палладия в нем выше 0,2 г/л.
При растворении анода платина, так же, как и палладий, в основном переходит в шлам. Однако некоторое ее количество может все же перейти в электролит. Так как ее потенциал (+1,2 В) положительнее потенциала серебра, то она будет осаждаться на катоде в первую очередь. Поэтому при содержании в анодах платины, так же, как и в случае с палладием, ведут контроль состава электролита. Максимальное содержание в нем платины составляет 0,025 г/л.
Из всех недрагоценных металлов в металле анода обычно преобладает медь, имеющая стандартный потенциал +0,337 В. Поэтому она легко растворяется на аноде и при небольших концентрациях не осаждается на катоде. Тем не менее, присутствие значительного количества меди в электролите может привести к ряду нежелательных явлений.
При прохождении тока через электролит перенос зарядов осуществляется как ионами меди, так и ионами серебра. Но так как ионы серебра принимают участие в катодном процессе, а ионы меди не разряжаются на катоде и накапливаются в прикатодном пространстве, то концентрация ионов серебра у катода может стать значительно ниже, а концентрация ионов меди гораздо выше, чем в объеме электролита. Вследствие соответствующего понижения потенциала разряда ионов серебра и повышения потенциала разряда ионов меди в прикатодном слое электролита могут возникнуть такие условия, при которых начнется совместное осаждение этих металлов на катоде. Вероятность совместного осаждения серебра и меди возрастает при повышении плотности тока и недостаточно интенсивном перемешивании электролита. Во избежание этого содержание меди в электролите тщательно контролируют. Предельной концентрацией меди считается 100 г/л; при этом концентрация серебра не должна быть ниже 110 г/л. В среднем в рабочем электролите содержится 30…60 г/л Сu. Электролитическое рафинирование сплавов серебра, в которых присутствует более 7,5 % Сu, экономически невыгодно, так как приходится очень часто менять электролит вследствие быстрого накопления в нем меди выше допустимого предела.
Присутствующие в анодном металле свинец и висмут переходят в электролит, но затем вследствие гидролиза частично выпадают в шлам (висмут в виде гидроксида, а свинец в виде пероксида).
Попавшие в катодный осадок висмут и свинец легко удаляются при промывке кристаллов серебра слабой азотной кислотой и поэтому при небольших содержаниях в аноде не вызывают затруднений.
Присутствующие в анодах небольшие количества железа и цинка вследствие своих электроотрицательных потенциалов (-0,44 и -0,76 В, соответственно) переходят в раствор и удаляются при смене и регенерации электролита.
Присутствующий в анодах селен, растворяясь на аноде, в дальнейшем почти полностью выпадает из раствора в шлам в виде Аg2SеO4 и на процесс электролиза существенно не влияет. При плавке катодного осадка попавший в него селен при небольшом абсолютном содержании полностью выгорает.
Очень вредной примесью при электролизе серебра является теллур. При содержании в анодном металле выше 0,2 % теллура процесс электрохимического рафинирования серебра расстраивается. При растворении анода, содержащего теллур в форме теллурида серебра Аg2Те, возможны следующие процессы:
![]() (12)
(12)
![]() (13)
(13)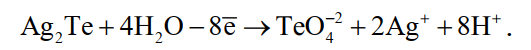 (14)
(14)
Концентрация теллура в электролите невелика, так как он образует с серебром трудно растворимые соединения (например, AgHTeO3, Ag2TeO3 и др.), которые выпадают в осадок (шлам).
Часть теллура находится в шламе в элементарном состоянии. В катодный осадок теллур может попасть либо в результате катодного восстановления, либо механически — при захватывании кристаллами серебра малорастворимых соединений теллура. При содержании в анодном металле свыше 0,2 % Те процесс электролиза идет с выделением оксидов азота и образованием серых губчатых осадков. Последние образуются уже при содержании в электролите 16…30 мг/л Те. Поэтому теллур следует тщательно удалять в предшествующих операциях.
Таким образом, для получения катодного серебра высокого качества и нормального течения процесса электролиза количество примесей в анодном металле не должно превышать определенных значений. Практикой работы аффинажных заводов установлено, что содержание серебра в анодах должно быть не менее 75 %, золота не выше 20 % и примесей не более 7,5 %. Содержание теллура не должно превышать 0,2 %.
Электролиз серебра обычно ведут в прямоугольных ваннах, изготовленных из винипласта, поливинилхлорида или фарфора и заключенных в каркас из стали, фибергласа и др. (рис. 5). Вместимость одной ванны составляет до 600 л.
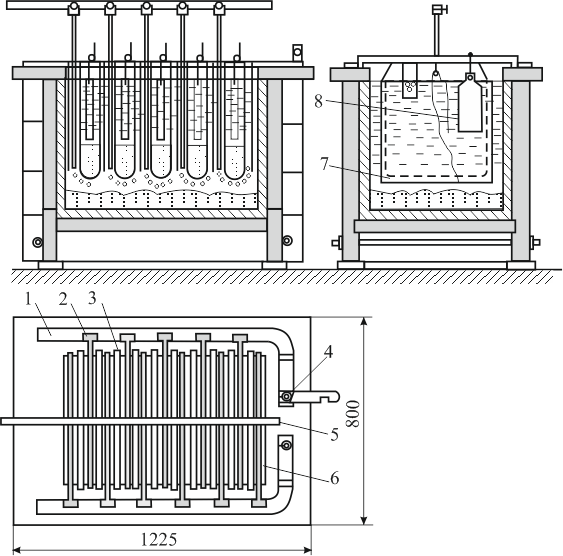
Рисунок 5 – Ванна для электролиза серебра с вертикальными электродами: 1 – шина; 2 – катодные штанги; 3 – чехлы; 4 – выключатель; 5 – воздушная труба с отводами для перемешивания: 6 – анодные штанги; 7 – катод; 8 – анод
Для переработки анодного шлама и анодов с повышенным содержанием золота, растворение которых идет с большим выходом анодного шлама, применяются в основном вспомогательные ванны с вертикальными анодами. Известно также применение ванн и с горизонтальными электродами. На анодной штанге подвешивают от 1 до 5 анодов (рис. 5). Катод обычно делают один на всю ширину ванны. В качестве катодов применяют тонкие листы коррозионностойкой стали, титана, алюминия или серебра.
Силовые линии при электролизе распределяются неравномерно, концентрируясь в нижней части электродов. Поэтому нижняя часть анодов растворяется быстрее верхней части. Во избежание этого аноды иногда отливают утолщенными книзу частями. Для лучшего контакта с токоподводящими шинами и снижения выхода анодных остатков удобно пользоваться сплошными анодами, отлитыми вместе с ушками для подвешивания в ванну. Аноды массой до 10 кг рассчитаны на растворение в течение 2…3 суток, рис. 6.

а)

б)
Рисунок 6 – Электролизная ванна для аффинажа серебра: а) — ванна электролизная, б) – катод с аффинированным серебром
Процесс электролиза ведут круглосуточно. Серебро осаждается на катоде в виде крупнокристаллического, неплотно пристающего к катоду осадка. Кристаллы серебра растут по направлению к аноду, стремясь замкнуть электроды. Поэтому их периодически счищают вручную лопатками или непрерывно механическими скребками. Электролит перемешивают либо с помощью сжатого воздуха, подаваемого в ванну по винипластовым или стеклянным трубкам, либо механическими скребками одновременно со снятием катодного осадка. Упавшие на дно ванны кристаллы серебра периодически извлекают дырчатыми совками из алюминия. Иногда одну из боковых стенок ванны делают наклонной и по ней скребком выгребают катодное серебро. Применяют и другие методы разгрузки, в частности непрерывную механическую разгрузку с помощью транспортера с лентой из полотна.
Во избежание загрязнения катодного серебра анодным шламом аноды помещают в чехлы из хлорвиниловой, териленовой или другой ткани. При растворении анода шлам собирается внутри чехла, откуда его периодически выгружают.
Очевидно, что поскольку на катоде осаждается только серебро, а на аноде растворяются серебро и примеси, катодный выход по току заметно превышает анодный. Это приводит к тому, что электролит в течение электролиза постепенно обедняется серебром и обогащается примесями. Отработанный электролит выводят из ванн, заменяя свежим.
При выборе плотности тока исходят из условия получения чистых катодных осадков. При высоких плотностях тока вследствие повышенной анодной поляризации усиливается переход платиновых металлов в раствор, а, следовательно, и их осаждение на катоде. Одновременно вследствие поляризации катода могут создаваться условия для восстановления на нем меди и теллура. Практически процесс ведут при плотностях тока 200…600 А/м2, при этом чем грязнее аноды, тем ниже плотность тока. Температура электролита за счет тепла, выделяемого при прохождении тока, составляет 30…50 °С.
Катодный выход по току при нормальном ведении процесса составляет 94…96 %, напряжение на ванне 1,0…2,5 В.
Расход электроэнергии колеблется в пределах 0,3…0,6 кВт·час на 1 кг аффинированного серебра.
Серебро, выгруженное из ванн, последовательно промывают разбавленной азотной кислотой, горячей водой, сушат и плавят в электрических высокочастотных печах в слитки. Чистота катодного серебра после переплавки составляет 99,97…99,99 %.
Помимо катодного серебра, продуктами электролиза являются также анодные остатки (в случае использования ванн с вертикальным расположением электродов), отработанный электролит и анодный шлам.
Анодные остатки, выход которых составляет примерно до 15% от массы исходных анодов, тщательно очищают от приставшего к нему шлама и возвращают в плавку на аноды. Возможна также доработка анодных остатков в ваннах с горизонтальными электродами.
Отработанный электролит поступает в ванны так называемого предварительного электролиза. Анодами в этих ваннах служат низкопробные серебряные сплавы.
В процессе предварительного электролиза происходит дальнейшее понижение концентрации серебра (которую можно понизить до 10 г/л) и повышение концентрации примесей. Оставшееся в растворе серебро осаждают хлоридом натрия. Хлористое серебро восстанавливают до металла цинковой пылью или железным порошком. Из обессеребренного электролита железом цементируют медь. Катодное серебро, получаемое в процессе предварительного электролиза, имеет недостаточно высокую пробу и поэтому вместе с цементным серебром поступает в плавку на аноды для основного электролиза.
Возможны и другие, более простые методы переработки отработанного электролита, в частности цементация серебра на медных листах и последующая цементация меди железным скрапом.
Свежий электролит готовят растворением серебряного сплава (99,0 % по сумме серебра и золота) в азотной кислоте плотностью 1,4, разбавленной 1:1.
Состав анодных шламов, получаемых при электролизе серебра, зависит от содержания золота в анодах и плотности тока. Чем выше содержание золота в анодах и плотность тока, тем богаче шлам по золоту. Обычно анодные шламы содержат 50…80 % Аu. Основная примесь в шламе – серебро, в меньших количествах присутствуют медь, теллур, платиновые металлы и т.д.
Для отделения основного количества серебра шлам выщелачивают азотной кислотой, при этом в раствор переходит также некоторое количество платиновых металлов. Для более полного выделения платиноидов и теллура полученный нерастворимый остаток обрабатывают 10 %-ным раствором хлорной извести или гипохлорита кальция и затем крепкой соляной кислотой при нагревании. В раствор переходят теллур, а также платиновые металлы и небольшое количество золота
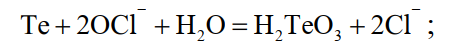 (15)
(15)
![]() (16)
(16) ![]() (17)
(17)
Нерастворимый остаток, в котором содержание золота достигает 98,0 % и более, направляют на плавку, с целью получения, золотых анодов для электрохимического рафинирования золота.
Азотнокислые растворы, полученные при обработке шлама азотной кислотой, упаривают до содержания серебра 800…1000 г/л и кристаллизуют. Маточные растворы вновь направляют на упаривание, а выпавшие кристаллы нагревают до 300 °С. При этой температуре азотнокислое серебро плавится (температура плавления 208 °С) без разложения, тогда как азотнокислые соли недрагоценных металлов разлагаются с образованием нерастворимых в воде оксидов и основных солей. В нерастворимое состояние переходят также платиновые металлы. Расплав выливают в воду для выщелачивания азотнокислого серебра. Полученный раствор используют в качестве электролита. Нерастворимый остаток оксидов и основных солей служит материалом для извлечения платиновых металлов.
Раствор, содержащий теллур, платиновые металлы и часть золота, упаривают, а затем нейтрализуют содой для осаждения теллура в виде ТеО2. Золото осаждают хлористым железом, а платиноиды цементируют металлическим железом
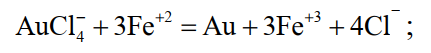 (18)
(18)
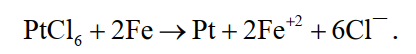 (19)
(19)
В последнее время со стороны промышленности растет спрос на металлы высокой чистоты. В частности, для ряда отраслей техники требуется серебро c содержанием 99,999 и даже 99,9999 %.
Серебро высокой чистоты получают электролизом в три цикла. Электролит содержит 120…150 г/л Ag и около 1 % свободной HNO3. Электролиз ведут в небольших ваннах из винипласта (фарфора, алунда). Плотность тока в первом цикле электролиза 400 А/м2, во втором и третьем 250…300 А/м2.
Электролит для первого цикла готовят растворением металла чистотой 99,99 %. В качестве анодов используют аффинированное серебро той же чистоты. Катодное серебро первого цикла плавят в специальной печи в тиглях из чистого графита. Оно служит для приготовления анодов и электролита второго цикла. Электролит для второго цикла приготовляют растворением полученного серебра в разбавленной 1:1 химически чистой НNО3. Полученный раствор упаривают до содержания серебра 1200…1300 г/л и охлаждают. Выпавшие кристаллы отделяют от маточного раствора, загружают в серебряный сосуд и прокаливают при 300 °С. Расплав сливают в воду, перемешивают и дают отстояться. Раствор фильтруют и заливают в электролизные ванны. В качестве анодов второго цикла берут серебро, полученное в первом цикле.
Аноды и раствор для третьего цикла готовят из серебра второго цикла.
Полученный в третьем цикле катодный осадок переплавляют в тиглях из чистого графита, как правило, в индукционных тигельных печах, рис. 7.

а)

б)
Рисунок 7 – Процесс разливки аффинированного серебра, из тигельной индукционной печи с частотой питания 3000 Гц: а) – разливка серебра проводят в атмосфере восстановителя, б) – аффинированные слитки 99,99 %, массой 28…30кг
Серебро высокой чистоты получают в специальном помещении, тщательно очищенное от пыли и газов – «чистая комната». Все оборудование изготовляют из винипласта, фарфора, серебра. В качестве реактивов применяют химически чистую азотную кислоту и воду, подвергнутую двукратной перегонке (бидистилят).
Электрохимическое рафинирование золота. Аффинаж золота электролизом позволяет получать металл высокой чистоты.
Аноды отливают из рафинируемого сплава, содержащего в качестве примесей серебро, платиновые металлы и некоторые недрагоценные металлы. Электролитом служит водный раствор золотохлористо-водородной кислоты с добавкой соляной кислоты.
Схематически процесс можно представить следующим образом:
![]()
Золотохлористоводородная кислота является сильной и полностью диссоциирует на ионы
![]() (20)
(20)
В свою очередь, анионы АuСl—4 частично диссоциирует с образованием катионов Аu+3
![]() (21)
(21)
Однако константа диссоциации Кд этого комплекса очень мала (Кд=5·10-22), т. е. равновесие реакции смещено влево.
В водном растворе ионы АuСl- могут подвергаться гидролизу
![]() (22)
(22)
но в кислом растворе гидролиз практически не идет.
Таким образом, можно считать, что золото в электролите находится в форме аниона АuСl—4 .
Основной катодный процесс при электролитическом рафинировании золота представляет собой восстановление анионов металлического золота АuСl—4 до
![]() (23)
(23)
Стандартный потенциал этого процесса равен +0,99 В, поэтому конкурирующий с ним процесс восстановления водорода практически исключен.
На аноде происходит растворение рафинируемого сплава с переходом золота в раствор:
![]() (24)
(24)
Так как стандартные потенциалы хлора и кислорода значительно электроположительное, чем потенциал золота, то выделение их на аноде в нормальных условиях электролиза невозможно
![]() (25)
(25)
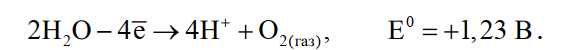 (26)
(26)
Однако характерная и весьма важная особенность анодного поведения золота — его склонность к пассивированию. При переходе золота в пассивное состояние растворение анода прекращается, потенциал его смещается в положительную сторону и достигает такой величины, при которой становится возможным выделение газообразного хлора.
Явление пассивирования крайне нежелательно: на аноде вместо полезного процесса растворения золота происходит вредный процесс — окисление ионов хлора, что приводит к обеднению электролита золотом и ухудшению атмосферы в цехе.
Во избежание пассивирования анода и выделения на нем хлора необходимо иметь достаточно высокую кислотность и температуру электролита. При этом, чем выше анодная плотность тока, тем больше должно быть в электролите соляной кислоты и тем выше должна быть его температура. Повышение концентрации соляной кислоты и температуры, помимо устранения пассивации золота, ведет к увеличению электропроводности электролита и, следовательно, к уменьшению расхода электроэнергии.
Другой, весьма существенной особенностью электролиза золота является то, что при растворении анода золото переходит в раствор не только в виде аниона АuСl—4 , но и в виде аниона АuСl—2
![]() (27)
(27)
Но так как электрохимический эквивалент одновалентного золота больше, чем трехвалентного, то анодный выход по току в расчете на трехвалентное золото оказывается выше 100 %.
Подобно тому, как это происходит в известном процессе электролиза меди, между анионами новесие АuСl—4 , и АuСl—2 устанавливается равновесие
![]() (28)
(28)
![]() (29)
(29)
Однако константа равновесия этой реакции в отличие от константы равновесия аналогичной реакции между ионами Сu+2 и Сu+ имеет значительно меньшую величину. Поэтому концентрация анионов АuСl—2 в электролите довольно значительна и вполне соизмерима с концентрацией анионов АuСl—4 .
Это приводит к тому, что на катоде существенное развитие получает процесс восстановления АuСl—2
![]() (30)
(30)
вследствие чего катодный выход по току в расчете на трехвалентное золото также превышает 100 %.
В реальных условиях электрохимического рафинирования концентрация образующихся на аноде анионов АuСl- превышает равновесную величину, вследствие чего равновесие приведенной выше реакции диспропорционирование смещается вправо и часть золота в виде тонкого порошка выпадает в анодный шлам. Извлечение золота из шлама требует дополнительных операций, поэтому необходимо предотвратить образование порошкового золота. Практикой установлено, что переход золота в шлам уменьшается с повышением плотности тока.
И, наконец, третьей характерной особенностью электрохимического рафинирования золота является то, что его обычно проводят при переменном асимметричном токе (процесс Вольвилля). Для этого последовательно с источником постоянного тока включают источник переменного тока с ЭДС, немного превышающей ЭДС постоянного тока.
Необходимость применения асимметричного тока вызвана специфическим поведением серебра при растворении анодного сплава. Будучи значительно отрицательнее золота, серебро легко окисляется на аноде, образуя нерастворимый хлорид серебра
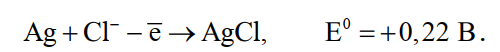 (31)
(31)
Если процесс электролиза вести с применением постоянного тока, хлористое серебро покроет анод толстой коркой, вследствие чего прекратится растворение золота и на аноде начнет выделяться газообразный хлор. Применение асимметричного тока позволяет избежать этих трудностей.
При использовании асимметрического тока на аноде чередуются полупериоды положительного знака с более короткими полупериодами отрицательного знака.
При анодной поляризации происходит растворение сплава и образование пленки хлористого серебра.
Во время катодной поляризации пленка AgCl теряет сцепление с анодом и падает на дно ванны, переходя в анодный шлам. Причина этого явления заключается, по-видимому, как в частичном восстановлении хлористого серебра до металла (в местах соприкосновения с анодом), так и в быстром и значительном изменении межфазного поверхностного натяжения на поверхности анода, происходящем при изменении поляризации.
Применяя асимметричный ток, можно вести электролиз сплавов, содержащих до 20 % Аg. При этом отношение напряжения переменного тока к напряжению постоянного тока (Uпер/Uпост.) должно быть тем больше, чем больше содержание серебра в анодах.
Если содержание серебра в анодах невелико (менее 6 %), то электролиз золота можно вести, применяя обычный постоянный ток. В этом случае хлористое серебро легко падает в анодный шлам, не образуя прочной пленки.
Кроме серебра в золотых анодах присутствуют медь, свинец, висмут, теллур, железо, олово, мышьяк, сурьма, платина и палладий. Механизм растворения такого многокомпонентного сплава очень сложен.
Медь, значительно более электроотрицательная, чем золото, переходит в раствор, и ее накопление в электролите, после известного предела, создает опасность совместного разряда меди и золота. Поэтому при большом содержании меди в анодах (свыше 2 %) необходимо менять электролит. Допустимое содержание меди в электролите составляет 90 г/л.
Еще более электроотрицателен свинец. Растворяясь на аноде в первую очередь, он остается в электролите в концентрациях, определяемых растворимостью РbСl2. При насыщении электролита хлоридом свинца на аноде может образоваться пленка твердой соли РbСl2, которая будет отлагаться совместно с хлоридом серебра, вызывая пассивирование анода. Если содержание серебра и свинца в сумме не превышает 13 %, аноды не пассивируются.
Висмут, как и свинец, легко растворяется на аноде и содержание его в сплаве до 0,3 % не вызывает затруднений. При совместном присутствии в золотом сплаве 0,6 % Ві; 0,9 % Рb и 12 % Аg анод пассивируются плотной пленкой, которая образуется из солей этих металлов. В присутствии серы небольшие количества свинца и висмута вызывают частичную или даже полную пассивацию анода. Так, установлено, что сплавы, в которых присутствует 3,6…10,1 % Рb и 2,16…6,87 % S, при электрохимическом растворении покрываются плотной пленкой сернистых соединений, сильно затрудняющей растворение. Сплавы с 13 % Рb, ~3 % Ві, ~12 % S совсем нерастворимы при пропускании тока.
При содержании в сплавах сульфидов свинца и висмута рекомендуется предварительно окислить сплав, добавляя марганцевокислый калий в расплавленный металл в количестве, в 3…5 раз превышающем теоретически необходимое для реакции окисления серы. При плавке в качестве покровного флюса добавляют соду.
Теллур растворяется на аноде и накапливается в электролите. При значительном содержании теллура в электролите ухудшается качество катодных осадков.
Вредной примесью при электролизе является железо. Переходя в раствор в виде ионов Fе+2, оно восстанавливает из электролита золото и повышает его содержание в шламе.
Олово, мышьяк и сурьма, находясь в сплаве в небольших количествах (до 0,05 %), хорошо растворяются и затруднений не вызывают.
Платина и палладий растворяются на аноде, образуя платинохлористоводородную кислоту и хлористый палладий. Так как стандартные потенциалы этих металлов близки к стандартному потенциалу золота:
![]() (32)
(32)
![]() (33)
(33)
то при чрезмерном накоплении в растворе их осаждение может начаться на катоде совместно с золотом. Предельно допустимая концентрация платины в электролите составляет 50 г/л, палладия 15 г/л.
Рутений, родий, осмий и иридий (если они присутствуют в анодах) полностью переходят в шлам.
Электролиз золота ведут в небольших ваннах из фарфора или винипласта вместимостью 20…65 л.
В отечественной практике применяют фарфоровые ванны вместимостью 25 л. В качестве катодов используют золотую жесть толщиной 0,1…0,25 мм, изготовляемую прокаткой чистого электролитного золота. Для придания катодам жесткости их подвергают рифлению на специальном прессе. В ванны (рис. 8) подвешивают 18 катодов на шести штангах (по три катода в ряд) и 15 анодов на пяти штангах (по три анода в ряд).
Масса одного анода составляет примерно 2 кг. Аноды подвешивают к штангам с помощью золотых ленточек, вплавленных в металл при отливке анодов. Для поддержания необходимой температуры электролита ванна устанавливается в водяной бане. Электролит перемешивается сжатым воздухом, подаваемым в ванну по стеклянным трубкам. Так как при электролизе выделяется хлор, ванны помещают в специальном вытяжном шкафу. Ток подводят снаружи шкафа по медным шинам, а внутри — серебряным как более стойким в атмосфере хлора материалом. Из серебра же делают штанги для подвески электродов.
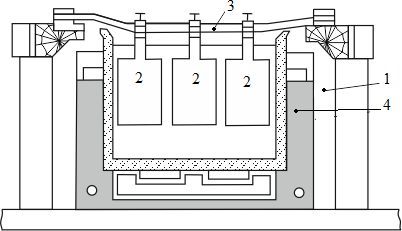
Рисунок 8 – Ванна для электролиза золота: 1 – фарфоровый корпус; 2 – аноды; 3 – штанга для подвески анодов; 4 – водяная баня
Электролит содержит 70…200 г/л Аu и 40…100 г/л HCl. Температура электролита 50…60 °С. Электролиз ведут асимметрическим током плотностью 600…1500 А/м2. Сила переменного тока обычно на 10 % выше, чем постоянного. Напряжение на ванне 0,5…1 В. Золото осаждается на катоде в виде плотного блестящего осадка. Катоды разгружают 3…4 раза в сутки в зависимости от плотности тока.
Катодное золото промывают горячей водой, очищают щетками, обрабатывают соляной кислотой или аммиаком (для растворения случайно приставших частиц хлорида серебра), снова промывают водой, сушат и плавят в индукционной печи в слитки. Чистота катодного золота 99,98…99,99 %. Основными примесями в нем являются серебро, медь и железо.
Анодный шлам выгружают из ванн и отмывают водой от электролита. Промывные воды используют для доливки ванн. Шлам загружают в сетчатый серебряный барабан, помещенный в наполненную водой ванну. При вращении барабана хлорид серебра через отверстия смывается в ванну, а более крупные частицы золотого анодного скрапа и дендриты катодного золота остаются в барабане. Золотые остатки сушат и возвращают в плавку на аноды. Хлористое серебро восстанавливают железным скрапом или порошком в солянокислой среде, промывают водой и плавят в аноды для серебряного электролиза.
Выход анодного скрапа при электролизе золота зависит от чистоты анодов и колеблется от 10 до 20 % от массы исходных анодов. Так же, как и шлам, остатки анодов отмывают в сетчатом барабане от хлорида серебра и электролита, сушат и плавят в аноды.
В процессе электролиза электролит обогащается примесями и обедняется по золоту. При работе на грязном электролите возможно загрязнение катодных осадков вследствие осаждения примесей. Помимо этого, при загрязнении электролита на катоде начинается рост дендритов, что приводит к замыканию электродов, а на аноде – кристаллизация солей, ведущая к пассивации анодов. Электролит не годен к дальнейшему использованию, если концентрация золота в нем ниже 100 г/л, а концентрация примесей выше следующих пределов, г/л: 90 – Сu; 50 – Pt; 15 – Pd; 1,5 – Pb; 4 – Те; 2 – Fe.
Для переработки отработанный электролит заливают в специальные ванны, где электролизом с нерастворимыми анодами из него извлекают большую часть золота. Катодами служат тонкие золотые пластины, аноды изготавливают из графита. Процесс ведут при постоянном токе плотностью 200…500 А/м2.
Из полученного раствора хлористым аммонием осаждают платину и палладий, а затем с помощью раствора хлористого железа осаждают остатки золота. Медь цементируют железом.
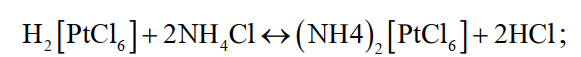 (34)
(34)
![]() (35)
(35)
Возможны и другие методы переработки отработанного электролита, в частности с применением ионообменных смол.
Свежий электролит готовят электрохимическим растворением относительно чистых сплавов золота, получаемых чаще всего в результате обработки анодного шлама серебряного электролиза. Растворение ведут в специальных ваннах круглой формы, снабженных диафрагмами из пористого фарфора, глины или ионообменной пленки.
В диафрагму завешивают 6…8 анодов и заливают соляную кислоту плотностью 1190 кг/м3 разбавленную водой в отношении 3:1. По обе стороны от диафрагмы подвешивают катоды – тонкие пластины из золота или графита. В катодное пространство заливают более разбавленную (1:3) соляную кислоту. При пропускании постоянного тока на аноде растворяется золото, на катоде — восстанавливается водород. Суммарная реакция выражается следующим уравнением
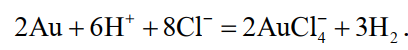 (36)
(36)
Процесс ведут с помощью постоянного тока плотностью 800…2000 А/м2. Напряжение на ванне для диафрагмы из ионообменной пленки составляет до 4 В, для диафрагмы из глины — до 14 В. Температура электролита 60…90 °С.
Полученный раствор содержит 200…300 г/л Аu и 45…80 г/л соляной кислоты. Его разбавляют водой и заливают в ванны основного электролиза. Свежий электролит можно также готовить растворением катодного золота в соляной кислоте при пропускании газообразного хлора.
Достоинством процесса электролитического рафинирования золота является не только возможность получения высокочистого металла, удовлетворяющего требованиям современной техники, но и попутное извлечение металлов платиновой группы, теряемых при аффинаже хлорированием. В ЮАР электролитическому рафинированию подвергают часть золота, прошедшего аффинаж хлорированием. При этом на электролиз предпочтительнее направлять те партии золота, в которых содержатся металлы платиновой группы. На рис. 9 представлена описанная выше технологическая схема электролитического разделения серебряно-золотого сплава с содержанием золота в нем менее 30 % методом двойного электролиза.
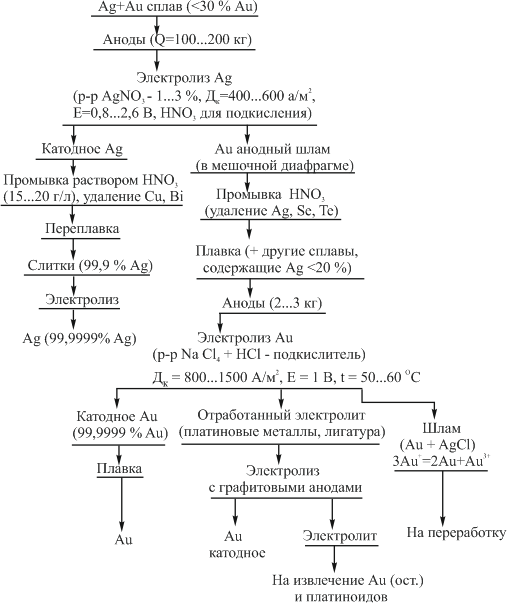
Рисунок 9 – Технология электролитического разделения серебрянозолотого сплава
Кислотные методы аффинажа применяют при обработке сплавов драгоценных металлов различными кислотами, причем примеси и один из драгоценных металлов переходят в раствор, а второй остается в нерастворимом остатке. Способ очистки при помощи азотной кислоты основан на избирательном растворении серебра. Для полного разделения металлов необходимо, чтобы содержание серебра в сплаве, по меньшей мере, в два (а лучше в три) раза превышало содержание золота. При этом условии обработка сплава горячей азотной кислотой позволяет полностью перевести серебро в раствор, а золото оставить в нерастворимом остатке.
Такие примеси, как медь, свинец, платина и палладий, также переходят в раствор. Если в сплаве присутствует олово, сурьма или мышьяк, то его следует предварительно переплавить с селитрой или подвергнуть купелированию для отделения этих элементов.
Перешедшее в раствор серебро осаждают в виде хлорида, восстанавливают металлическим железом или цинком и переплавляют в слитки. Золотой остаток промывают, сушат и плавят в слитки чистотой до 99,8 %.
Вместо азотной кислоты для растворения сплавов можно использовать концентрированную серную кислоту (способ д’Арсе). Как и в предыдущем методе, количество серебра в исходном сплаве должно быть примерно втрое больше золота, а меди не более 7,5 %. Иначе разварка сплава затрудняется, так как на его поверхности отлагается сульфат меди, мало растворимый в концентрированной серной кислоте.
Гранулированный или отлитый в тонкие пластины сплав загружают в чугунные котлы и заливают концентрированной серной кислотой. При нагревании серебро, медь и другие недрагоценные металлы переходят в раствор
![]() (37)
(37)
![]() (38)
(38)
Золото остается в нерастворимом остатке.
По окончании процесса сернокислый раствор сливают, а оставшийся золотой осадок для окончательной очистки обрабатывают новой порцией концентрированной серной кислоты.
Полученное в результате этих операций золото промывают, сушат и переплавляют в слитки 99,6…99,9 %. Из сернокислого раствора, содержащего серебро, медь и небольшое количество других металлов, с помощью металлической меди при нагревании осаждают серебро.
В некоторых случаях для использования свободной серной кислоты из горячих растворов охлаждением выкристаллизовывают сернокислое серебро. Маточный раствор сливают и, добавив свежую кислоту, применяют для разваривания новой порции сплава. Кристаллы сернокислого серебра растворяют в горячей воде и восстанавливают железом. Восстановленное серебро тщательно промывают горячей водой, сушат и плавят в слитки 98,0…99,0 % Ag.
Способ очистки при помощи царской водки применим лишь к сплавам, содержащим небольшое количество серебра. Подлежащий очистке гранулированный сплав обрабатывают при нагревании царской водкой. Золото переходит в раствор, образуя золотохлористоводородную кислоту, а серебро в форме хлорида остается в нерастворимом остатке. Из осадка хлористого серебра получают металлическое серебро, пользуясь каким-либо рассмотренным выше способом.
Золотосодержащий раствор сливают, выпаривают досуха для удаления азотной кислоты, соли растворяют в воде, полученный раствор отфильтровывают и с помощью восстановителей (например, щавелевой кислоты или железного купороса) восстанавливают из него металлическое золото. После промывки золото сплавляют в слитки 99,8…99,9 % Аu.
Кислотные методы аффинажа громоздки, дороги и не позволяют получать драгоценные металлы той степени чистоты, которая необходима для современной промышленности. Из-за этих недостатков кислотные методы в настоящее время применяются ограниченно. Иногда их используют для предварительного разделения драгоценных металлов перед окончательным аффинажем их электрохимическим методом.
1.2 Аффинаж металлов платиновой группы (МПГ)
Концентраты металлов платиновой группы, полученные непосредственно из коренных руд или после переработки анодных шламов, и шлиховую платину из россыпных руд передают на аффинажные заводы для получения металлов платиновой группы (МПГ).
Сегодня платина не только драгоценный металл, но, что значительно важнее, один из важнейших материалов технической революции. Один из организаторов платиновой промышленности, профессор Орест Евгеньевич Звягинцев, сравнивал значение платины со значением соли при приготовлении пищи – нужно немного, но без нее не приготовить обеда.
Первое практическое применение этому металла уже в середине XVIII в. нашли фальшивомонетчики. В то время платина ценилась в два раза ниже, чем серебро, а плотность ее велика – около 21500 кг/м3 и с золотом и серебром она хорошо сплавляется. Пользуясь этим, стали подмешивать платину к золоту и серебру, сначала в украшениях, а затем и в монетах.
Технологические схемы аффинажа платиновых металлов насчитывают десятки взаимосвязанных операций с многочисленными оборотами растворов и полупродуктов, с постепенным выделением тех соединений, из которых непосредственно можно получить очищенные платиновые металлы.
Сырьем для получения платиновых металлов служат: шлиховая платина, извлекаемая при разработке и обогащении россыпей, концентраты, выделяемые в результате обогащения и гидрометаллургической обработки анодных шламов электролиза никеля и меди, лом вторичных платиновых металлов и др.
Шлиховая платина – это смесь зерен самородной платины, представляющая собой сплав платиновых металлов с железом, медью, никелем и другими элементами. Для шлиховой платины характерен следующий состав, %: до 85…90 Pt; 1…3 Ir; <1 Rh и Ru; до 15 Fe.
Обогащенные анодные шламы содержат, %
| Pt | 15…20 | Te | 1,5…2,5 | Au | 1,5…2,0 | S | 2,0…5,0 |
| Pd. | 35…45 | Ni | 0,6…2,5 | Se | 1,0…1,67 | ||
| Rh | 0,4…0,6 | Cu | 0,7…2,5 | Ag | 8…10 | ||
| Ir | 0,04…0,08 | Fe | 1,5…4,0 | Ru | 0,08…0,15 |
Шлиховую платину вследствие высокого содержания в ней платины и относительно малого количества загрязняющих элементов — серы и цветных металлов — перерабатывают по относительно простой схеме. Основными операциями являются растворение, доводка растворов и избирательное осаждение платиновых металлов.
Первый этап переработки шлиховой платины – ее растворение в царской водке, которую готовят смешением соляной кислоты (плотность 1120 кг/м3) и азотной (плотность 1580 кг/м3) в объемном отношении 3:1. Вследствие высокой плотности шлиховой платины и быстрого оседания ее на дно реактора растворение осуществляют в чане с набором тарелок или при интенсивном перемешивании с помощью механических мешалок.
Вначале шлихи растворяют без подогрева, так как в первое время реакция растворения протекает весьма энергично, а затем (через 4…5 часов) подогревают до 110…120 °С, что ускоряет процесс растворения, который заканчивается примерно через сутки. Растворение платины идет по реакции
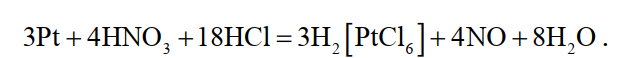 (39)
(39)
В раствор переходит свыше 99 % платины. Количество нерастворимого остатка обычно находится в пределах 4…6 % поступающей на растворение массы шлиховой платины. В этом остатке содержится до 10 % платины.
Для избирательного осаждения платины, которая находится в виде нерастворимого хлорплатената аммония (NH4)2[PtCl6], необходимо вначале перевести иридий (IV) и палладий (IV), соответственно, в иридий (III) и палладий (III), иначе при осаждении платины хлористым аммонием иридий (IV) и палладий (IV) также выпадут в осадок в виде труднорастворимых соединений (NH4)2[PdCl6] и (NH4)2[IrCl6], загрязняющих платиновый осадок.
Раствор обрабатывают последовательно 5; 12,5 и 25% раствором хлористого аммония. При этом платина выпадает в осадок в виде хлорплатената
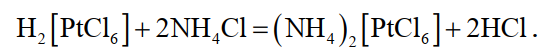 (40)
(40)
Полученный хлорплатинат отфильтровывают и промывают на фильтре 5 % раствором хлористого аммония. Осадок хлорплатената прокаливают в муфельных электропечах в течении 10…12 час. с постепенным повышением температуры до 1000 °С. При этом образуется губчатая платина, содержащая примеси других металлов. Поэтому ее измельчают, повторно растворяют в царской водке и осаждают в виде хлорплатината аммония.
Очищенная платиновая губка имеет светло-серый цвет с металлическим блеском: при ударе она не должна рассыпаясь в порошок. Платину изготовляют в виде прямоугольных слитков длиной 100±3 мм, шириной 65±2 мм. Масса слитка должна быть не более 5,5 кг. Допускается по согласованию с изготовителем и с потребителем изготавливать слитки платины другого размера и массы. Поверхность слитков должна быть чистой и обработана фрезерованием или шлифовкой.
Согласно требованиям ГОСТ 12341-81 допускается выпуск платины следующих марок: ПлА-0 с содержанием платины 99,98 %; ПлА-1 с содержанием 99,95 % и ПлА-2 с содержанием 99,90 %.
Разделение платиновых металлов и получение их в чистом виде очень сложно вследствие большого сходства их химических свойств; это требует большой затраты труда, времени, дорогих реактивов. Для получения чистой Pt исходные материалы – самородную платину, платиновые шлихи (тяжелые остатки от промывки платиноносных песков), лом (негодные для употребления изделия из Pt и ее сплавов) обрабатывают царской водкой при подогреве. В раствор переходят: Pt, Pd, частично Rh, Ir в виде комплексных соединений H2[PtCl6], H2[PdCl4], H3[RhCl6] и Н2[IrCl6], а также Fe и Cu в виде FeCl3 и СuCl2. Нерастворимый в царской водке остаток состоит из осмистого иридия, хромистого железняка (FеСrO2), кварца и других минералов.
Из раствора осаждают Pt в виде (NH4)2[PtCl6] хлористым аммонием. Но чтобы в осадок вместе с Pt не выпал Ir в виде аналогичного нерастворимого соединения (NH4)2[IrCl6] (остальные платиновые металлы NH4Cl не осаждает), предварительно восстанавливают Ir+4 до Ir+3 (например, прибавлением сахара Cl2Н22О11 по способу И.И. Черняева). Соединение (NН4)3[IrCl6] растворимо и не загрязняет осадка.
Хлорплатинат аммония отфильтровывают, промывают концентрированным раствором NH4Cl (в котором осадок практически не растворим), высушивают и прокаливают. Полученную губчатую платину спрессовывают, а затем плавят в кислородно-водородном пламени или в электрической высокочастотной печи. Из фильтрата, оставшегося после осаждения (NH4)2[PtCl6], и из осмистого иридия извлекают прочие платиновые металлы путем сложных химические операций. В частности, для перевода в растворимое состояние нерастворимых в царской водке платиновых металлов и осмистого иридия используют спекание с пероксидами ВаО2 или Na2O2. Применяют также хлорирование – нагревание смеси Pt-концентратов с NaCl и NаОH в струе хлора.
В результате аффинажа получают трудно растворимые комплексные соединения: гексахлорорутенат аммония (NH4)3[RuCl6], дихлорид тетрамминдиоксоосмияCl2, хлорпентамминдихлорид родияCl2, гексахлороиридат аммония (NH4)2[IrCl6] и дихлордиаммин палладияCl2.
Губчатые платиновые металлы плавят в вакуумной электрической печи высокой частоты. Применяют и другие способы аффинажа, в частности, основанные на использовании ионитов.
Первичную губку платиновую и иридиевую – очищают повторным растворением в царской водке с последующим осаждением в виде аммонийных солей соответствующих хлорметаллических кислот. После осаждения платины и иридия раствор подкисляют серной кислотой и цементируют из него палладий, родий и рутений железом или цинком.
Палладий выделяют из растворов H2PdCl4 действием аммиака и затем соляной кислотой и затем осадок дихлордиаммин палладияCl2 прокаливают в токе водорода с получением палладиевой губки
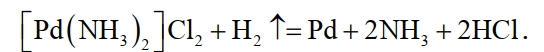 (41)
(41)
Родий можно выделить по способу В.В. Лебединского, когда раствор нейтрализуют щелочью и содой, а затем обрабатывают азотнокислым натрием
![]() (42)
(42)
Родий переходит в раствор, который отфильтровывают от гидратов и основных солей тяжелых металлов. Фильтрат, подкисленный уксусной кислотой, обрабатывают хлористым аммонием; при этом родий выделяется в виде кристаллического осадка
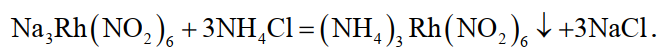 (43)
(43)
Аммонийную соль гексанитрита родия обрабатывают водным раствором едкого натрия. При последующем добавлении аммиака и хлористого аммония выпадает кристаллический осадок триамминнитрита родия, который при нагревании в атмосфере водорода при 900 °С превращается в губчатый родий.
Осмий извлекается из нерастворимого остатка первичной обработки сырья царской водкой. Этот остаток спекают с BaO2, измельченный спек обрабатывают смесью соляной и азотной кислоты. Тетраоксид осмия при этом перегоняется и улавливается из паров раствором едкого натра в виде Na2OsO4. Раствор обрабатывают гипосульфитом для восстановления шестивалентного осмия, а затем хлористым аммонием. Осмий выпадает в осадок в видеCl2, последний промывают, высушивают и прокаливают в атмосфере водорода, получая в итоге осмиевую губку
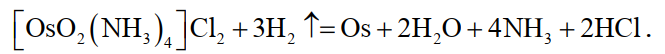 (44)
(44)
2. Технология выделения драгоценных металлов из растворов аффинажного производства
В современной практике аффинажа платиновых металлов, золота и серебра наибольшее распространение получили хлоридные и нитратные растворы. Химический состав промышленных растворов аффинажа золота и серебра приведен в табл. 3.
Таблица 3 – Химический состав промышленных растворов аффинажа золота и серебра
| Раствор | Содержание, г/л | |||||||||
| Au | Ag | Pt | Pd | Rh | Сu | Fе | Sе | Те | Рb | |
| 1.Отработанный золотосодержащий
электролит |
80…90 | 0,05 | 0,5 | 0,12 | 0,014 | 80…90 | 15 | 6,5 | 1,2 | 0,6 |
| 2.Раствор хлорирования анодного
шлама электролиза серебра |
10…12 | 0,04 | 2,2 | 0,7 | 0,04 | 4…5 | 5 | 9 | 9 | 0,1 |
| 3.Раствор хлорирования цианистых
шламов |
25…30 | 0,05 | — | — | — | 13…15 | 3,0 | 0,8 | 0,5 | 0,7 |
| 4.Растворы хлорирования
шлифовальных порошков |
15…17 | 0,03 | — | — | — | 0,6…0,9 | 1,0 | — | — | — |
| 5.Растворы отработанных электролитов
аффинажа серебра |
0,009 | 80…120 | 0,6…0,8 | 2…8 | 0,003 | 90 | 10 | 6 | 3 | 0,45 |
Содержание извлекаемых компонентов в них изменяется в широких пределах. Основные условия, которые учитывались при разработке технологических схем разделения и концентрирования, следующие:
- глубокое и избирательное извлечение интересующих компонентов;
- получение товарных продуктов или продуктов, удобных для последующей переработки;
- рациональная, с точки зрения использования экстракционного метода, комплексность извлечения попутных ценных компонентов;
- исключение наработки значительных объемов промышленных растворов;
- компактность технологии при малой продолжительности производственных циклов;
- отсутствие незавершенного производства.
Растворы, полученные при растворении цианистых шламов, анодных шламов электролитического рафинирования серебра, шлифовальных порошков на основе оксида хрома в «царской водке» с применением в качестве растворителя дихлорэтилового эфира (хлорэкса) требуют применения схем избирательного извлечения золота и других ценных компонентов. К недостаткам процесса следует отнести высокую растворимость экстрагента в рафинате, достигающую 0,3…0,5 %, недостаточно полное извлечение металла в органическую фазу (остаточное содержание золота в рафинате 200…300 мг/л). Обращает на себя внимание небольшая емкость экстрагента по извлекаемому металлу (12…15 %) и значительное разбавление растворов на стадии реэкстракции в водные растворы щелочей.
В целях исключения указанных недостатков экстракцию хлорных комплексов золота предложено осуществлять нефтяными сульфидами (НС). Природа органического сульфида оказывает незначительное влияние на извлечение золота. Изменением концентрации экстрагента можно достичь количественного перехода металла в органическую фазу независимо от содержания его в исходном водном растворе. Остаточное содержание золота в рафинате в этом случае составляет 3…8 мг/л.
При использовании 25 % раствора НС в керосине глубокое извлечение золота в органическую фазу обеспечивается после одного контакта органической фазы с водным раствором 1, после 12 контактов с раствором 2, пяти контактов с раствором 3 и девяти контактов с раствором 4. Остаточное содержание металла не превышает 5…12 мг/л. Процесс идет при соотношении V0:VB=1:1 и перемешивании фаз в течение 12…15 мин.
Следует отметить значительную совместную экстракцию палладия, достигающую ≈ 95 % от исходного содержания его в водном растворе.
Содержание золота в исходном растворе оказывает существенное влияние на насыщение экстрагента. При этом в процессе накапливания золота в органической фазе происходит вымывание совместно экстрагированных селена и железа.
Реэкстракция водным раствором сульфита натрия (V0:VB=1:1, 2М Na2SO3) в совокупности с последующим восстановлением золота сернистым газом, образующимся при разложении свободного реагента соляной кислотой, позволяет получить кондиционный по чистоте металл, не уступающий по своему качеству рафинированному электролизом металлу. Состав золотого кека, г/т: 39 золота, 14 палладия, 15 меди, 24 железа, 16 сурьмы, 28 олова, 13 висмута.
Потери органического раствора не превышают 0,01…0,02 % за цикл. Схема, представленная на рис. 10, прошла проверку и рекомендована к промышленному использованию на предприятиях. Внедрение схемы не требует капитальных затрат.
Рисунок 10 – Технологическая схема извлечения золота из промышленных растворов
Исследована экстракция золота из пульп, полученных в результате растворения в «царской водке» шлифовальных порошков на основе оксида хрома. Экстракция проводилась при комнатной температуре и соотношении пульпы (в пульпе отношение Т:Ж=1:5).
Концентрация экстрагента – 0,5 моль/г в керосине. Экстракция из пульп весьма эффективна. Удалось количественно перевести металл из пульповой фазы, причем потери органического раствора с твердым не превышают потерь в системе жидкость-жидкость. В качественном отношении полученный концентрат близок к выше приведенному. Существенного снижения активности экстрагента после контакта с водной фазой, содержащей окислитель, замечено не было.
Вопросы очистки отработанных солянокислых растворов электролитического рафинирования золота представляют значительный интерес как с точки зрения выделения из них ценных компонентов (драгоценные металлы, теллур, селен, медь и др.), так и возможности их возврата в процесс. Необходимость последнего состоит в том, что многократное применение одного и того же электролита на операции электролиза позволяет сконцентрировать в нем родий, иридий и рутений, исключив их безвозвратные потери. Накопленные результаты исследований по использованию экстракции, сорбции, цементации и других методов обеспечивают лишь частичное решение поставленной задачи. Разработана технология, обеспечивающая выделение присутствующих в растворе золота, палладия, платины, а также меди, селена, теллура и других металлов в самостоятельные продукты, удобные для последующего разделения.
Технология предусматривает на головной операции глубокое извлечение золота и палладия экстракцией с использованием нефтяных сульфидов в качестве растворителей. На стадии регенерации органической фазы получают два продукта: золотой (99,98 %) и палладиевый (81…82 %) концентраты. Из рафинатов выделяют селен, теллур, серебро, платину, родий, а оставшиеся золото и палладий выделяют цементацией металлической медью. Вероятность восстановления селена и теллура из хлоридных растворов медью оценивается электродвижущей силой (соответственно 0,4 и 0,68 В). Цементный осадок не должен содержать металлическую медь из-за протекания реакции
![]() (45)
(45)
Учитывая, что растворимость однохлористой меди зависит от состава электролита и рН среды (в воде при температуре 20 °С растворимость составляет 0,06 г/л), целесообразно корректировать фильтраты цементации по содержанию НСl и осаждать СuСl металлической медью. После фильтрации осадка раствор направляют на приготовление электролита, а осадок однохлористой меди — на репульпацию в соляной кислоте и цементацию металла алюминием. Цементный осадок частично используют в данном технологическом процессе.
Ниже приводятся технологические показатели отдельных операций. Металлы выделяли из растворов следующего состава, г/л: 0,08…0,2 золота, 0,06…0,08 серебра, 14…80 меди, 0,6…2,5 платины, 0,2…1,2 палладия, 0,006…0,008 родия, 1,5…1,7 теллура, 0,4…2,3 селена; 30…80 HCl.
Выделение золота и палладия. Экстракция золота и палладия осуществляется с использованием 10 % раствора НС в керосине при отношении V0:VB=1:2, комнатной температуре и продолжительности контакта фаз 20 мин. Остаточное содержание золота в рафинате — 0,0013, палладия — 0,004 г/л. Золото реэкстрагируют из органической фазы водным раствором сульфида натрия, палладий цементируют из экстракта металлическим цинком.
Выделение селена и теллура. Исследовано влияние температуры, расхода цементной меди, продолжительности перемешивания, а также содержания соляной кислоты на полноту осаждения селена и теллура. Установлено, что концентрация кислоты не оказывает заметного влияния на процесс. Глубокая цементация металлов медью при температуре 20 °С возможна уже при 20-кратном избытке меди против стехиометрического через 20…30 мин перемешивания раствора. При этом осадок восстановленных металлов сильно загрязнен однохлористой медью, и не обеспечивается глубокое выделение платиновых металлов. Цементация при температуре 80…90 °С позволяет снизить расход восстановителя в 2,0…2,1 раза и количественно извлечь как селен и теллур, так и драгоценные металлы. Извлечение меди при этом не превышает 0,05…0,08 % от исходного. Контрольная репульпация кека в 1,5 М HCl обеспечивает обогащение последнего.
Выделение меди. Установлено, что полное осаждение однохлористой меди зависит от трех факторов: концентрации соляной кислоты, расхода цементной меди и температуры.
На рис. 11 приведена зависимость извлечения CuCl из раствора от концентрации свободной HCl при температуре 20 °С и расходе металлической меди в 50 раз больше стехиометрического (кривая 1).
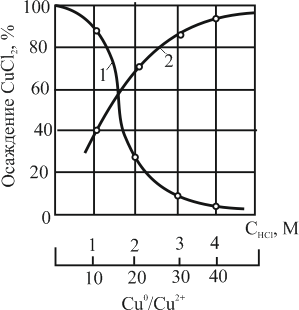
Рисунок 11 – Зависимость осаждения CuCl от концентрации HCl в растворе (1) и отношения Cu0/Cu+2 (2)
Оптимальное содержание кислоты в растворе не должно превышать 0,7…0,8 М.
Расход осадителя при этом должен быть в 40…45 раз больше стехиометрического (кривая 2). После отделения от раствора осадок репульпируют в 1,5 М растворе кислоты, из него медь цементируют алюминиевым порошком, рис. 12. Восстановленную медь используют в вышеприведенных операциях и частично отправляют в смежное производство.
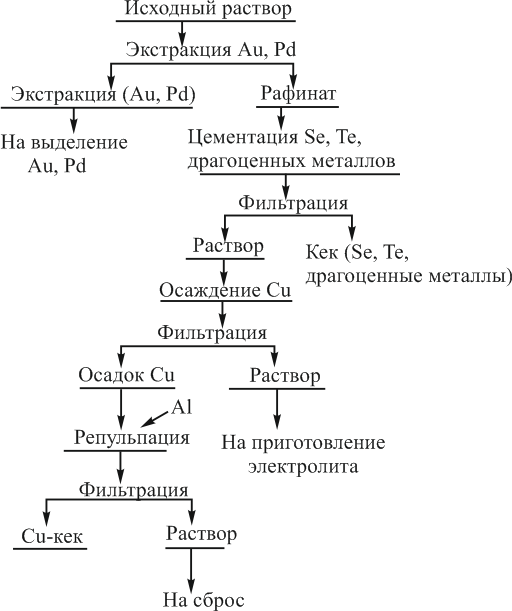
Рисунок 12 – Технологическая схема комплексного выделения из растворов отработанных золотосодержащих электролитов
В процессе электролитического рафинирования азотнокислые электролиты накапливают определенное количество цветных и платиновых металлов, при этом создается условие для осаждения их на катоде совместно с извлекаемым элементом.
Предельно допустимая концентрация меди в растворе не должна превышать 85…90 г/л, палладия и платины в сумме 5…7 г/л. По существующей технологии отработанные растворы выводят из процесса и отправляют на осаждение серебра хлористым натрием с последующей цементацией платиновых металлов медью. Осадки вновь возвращают на аффинаж. Недостатком технологической схемы является значительный объем незавершенного производства.
Предложена экстракционная технология извлечения драгоценных металлов из растворов отработанных электролитов с применением в качестве растворителей нефтяных сульфидов (НС), рис. 13.
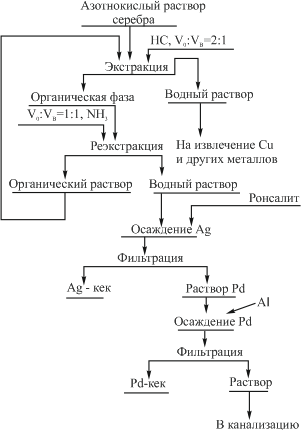
Рисунок 13 – Технологическая схема извлечения серебра из отработанных электролитов
Исходные водные растворы характеризуются значительным разнообразием и содержат, кроме серебра (до 120 г/л), 0,6…0,8 г/л платины, до 2,5 г/л палладия, 85…90 г/л меди, до 3,5 г/л железа, а также селен и теллур, и другие сопутствующие компоненты, 15…20 г/л HNO3.
Экстракция 25 %-ным раствором НС в керосине серебра и палладия протекает быстро. Извлечение ценных компонентов достигается при отношении V0:VB=2:1 и продолжительности контакта фаз 20…25 мин.
Органический раствор направляют на реэкстракцию аммиачной водой, которая является коллективным реэкстрагентом и позволяет на 99,5 и 99 % реэкстрагировать серебро и палладий соответственно. Из аммиачного раствора серебро избирательно осаждается ронгалитом, расход которого примерно в 10 раз больше стехиометрического. При этом получается кондиционный по чистоте металл (99,95 % Аg). Палладий цементируют из раствора алюминием. Полупромышленные испытания экстракционного извлечения драгоценных металлов из отработанных нитратных электролитов показали высокую эффективность предложенного метода.
Остаточное содержание серебра и палладия в растворахрафинатах меньше 0,5…0,7 мг/л.
Технологическая схема (рис. 6) дает возможность повысить прямое извлечение серебра в готовую продукцию, а также осуществить концентрирование палладия. В процессе хлорного вскрытия платиносодержащих концентратов в растворе накапливаются цветные и драгоценные металлы, кроме серебра, примерно в тех же соотношениях, что и в исходном сырье. Таким образом, данные растворы представляют собой сложные многокомпонентные системы следующего состава, г/л: 7,6 платины, 35,4 палладия, 0,6 родия, 0,01 иттрия, 0,7 рутения, 2,3 золота, 0,06 серебра, 23 меди, 26 никеля, 6,5 железа, 7,9 селена, 0,8 теллура.
Растворы после их соответствующей подготовки – восстановление золота до металла и перевод в низшие состояния окисления палладия (IV) и иридия (IV) — направляют на выделение платины в виде хлорплатената аммония (ХПА) и палладия в виде дихлородиаминопалладия (ДХДАП). При восстановлении золота, палладия и иридия платина должна оставаться в растворе четырехвалентной. Многочисленнее восстановители (сахар, спирт, палладий и др.) не обеспечивают избирательной подготовки. Около 10 % присутствующей в растворе платины переходит в двухвалентное состояние и не участвует в осаждении.
Основным недостатком существующих технологий аффинажа платины и палладия является исторически сложившаяся последовательность выполнения операций выделения металлов. Вначале из раствора извлекают платину в виде ХПА и далее палладий в виде ДХДАП. Современные производственные растворы платиновых концентратов содержат, как правило, в 3…4 раза больше палладия, чем платины. Поэтому совершенно закономерно, что основной примесью в ХПА является палладий. Аффинаж осадка прокаливания ХПА приводит к снижению извлечения платины в готовую продукцию примерно на 10 %.
Предложена технологическая схема аффинажа, предусматривающая экстракционное извлечение палладия из указанных растворов в голове процесса с последующим выделением платины, существующим методом. В качестве экстрагентов используют растворы НС в керосине. Экстракция палладия протекает с высокой степенью избирательности. При этом извлекаются золото, незначительно платина, селен, железо. Концентрация палладия в органическом растворе достигает 35…40 г/л.
Металл реэкстрагируется из органической фазы 25 %-ным раствором аммиачной воды при соотношении V0:VB=5:1. Аммиачные растворы направляют на осаждение из них палладия в виде ДХДАП.
Для повышения избирательности процесса экстракции палладия и технологичности реэкстракции необходима подготовка исходного раствора, суть которой состоит в предварительном хлорировании раствора, выведении свободного хлора прогреванием при температуре 90…95 °С и введении «трилона Б» с целью связывания железа в неэкстрагируемый комплекс. Хлорирование обеспечивает перевод платины и палладия в четырехвалентное состояние, а также окисление селена.
Палладий (IV) в хлористом растворе легко восстанавливается до двухвалентного, платина, железо, селен, и другие металлы имеют высшую валентность, кинетическая инертность которых к экстракции нефтяными сульфидами обеспечивает избирательное извлечение палладия.
Технологическая схема экстракции палладия из платиновых концентратов приведена на рис. 14.
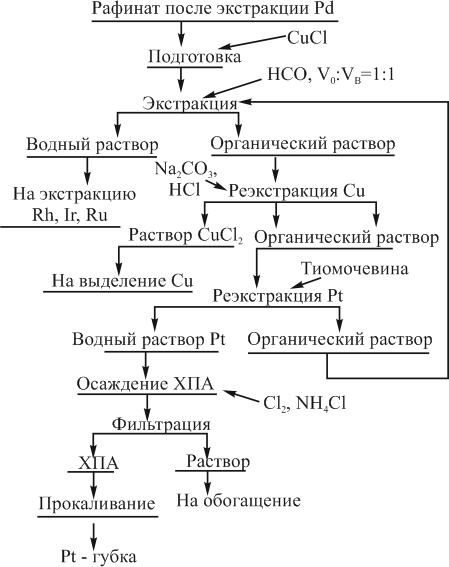
Рисунок 14 – Технологическая схема экстракции палладия из растворов хлорирования платиновых концентратов
Однако перекристаллизация соли ДХДАП из аммиачного реэкстракта обеспечивает получение кондиционного по чистоте металла следующего состава, %: 0,003 платины, 0,001 золота, 0,001 меди, 0,005 железа, 0,003 кремния, 0,01 олова, 0,01 рубидия, 0,002 алюминия, 99,965 палладия. Концентрат золота содержит более 98% извлекаемого элемента.
Рафинаты, полученные в результате экстракции палладия и содержащие от 5 до 20 г/л платины, железо, родий, иридий и рутений от сотен миллиграммов до 5…8 г/л, обрабатывают однохлористой медью из расчета массового отношения платина: медь ~ 0,6…0,8.
При этом протекает реакция взаимодействия хлоридных соединений платины с CuCl с образованием лабильных к внутри координационным превращениям комплексов. Такая подготовка водной фазы обеспечивает перевод экстракционного процесса из области, лимитируемой химической кинетикой в диффузионную область.
В результате удается осуществить процесс при комнатной температуре и обеспечить извлечение платины (98,5…99 %) через 15…20 мин. перемешивания фаз. Экспериментально подтверждена возможность накапливания в экстракте до 30…40 г/л платины при остаточном содержании металла в рафинате 25…35 мг/л.
В качестве экстрагента используется раствор НСО в керосине с добавкой 10 % октилового спирта. Соэкстракция родия не превышает 0,8…1,0 %, рутения 0,3…0,6 % и иридия 0,1 %.
Палладий, содержание которого в растворе составляет 16…20 мг/л, переходит в органическую фазу.
Что касается выделения платины и меди из органического раствора, то наиболее предпочтительным вариантом является последовательная реэкстракция меди в содовый раствор и платины в раствор тиомочевины. По этой технологии прямое извлечение металла возрастает на 6…7 % (рис. 15).
Экстракционные свойства сераорганических соединений (сульфидов и сульфооксидов) позволили использовать совокупность технических приемов и схем выделения и разделения драгоценных металлов.
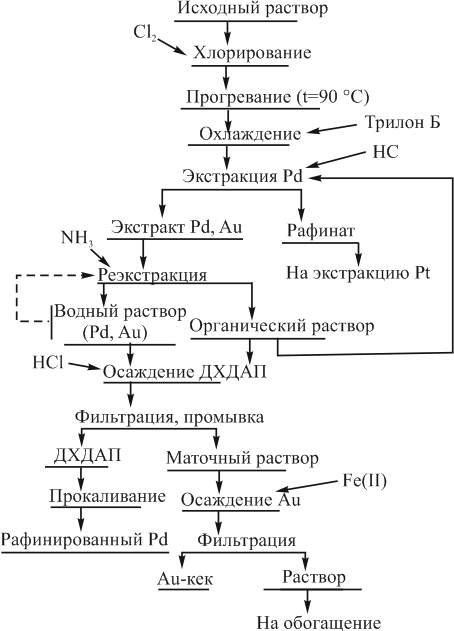
Рисунок 15 – Технологическая схема аффинажа платины при переработке рафинатов экстракции палладия
Технологическая реализация обогащения драгоценных металлов состоит в разработке схем их концентрирования из сульфатных электролитов, растворов хлорирования медного и никелевого шлама, хлоридных и нитратных электролитов аффинажа золота и серебра, а также растворов хлорирования платиновых концентратов на переделе выделения золота, палладия и платины экстракционных схем получения отдельно палладия, платины, золота и серебра при переработке хлоридных растворов коллективных концентратов, а также отработанных золотых и серебряных электролитов.
Качественно новые перспективы использования сераорганических растворителей открываются при непосредственном выделении драгоценных металлов из минерального и вторичного сырья, предусматривающие исключение традиционных методов химического вскрытия. Эффективность избирательной экстракции в системе твердое-жидкость доказана на примере коллективных платиновых концентратов, сульфидных и окисленных золотых гравитационных концентратов золотоизвлекательных фабрик, цианистых шламов, а также золотосодержащих отходов (шлифовальные порошки, лом радиоэлектронной техники).
Метод сульфидного вскрытия в присутствии окислителя (двухлористая медь) позволяет осуществить глубокое извлечение металлов в органическую фазу. В совокупности с разработанными приемами регенерации органической фазы скомпонованы технологические схемы аффинажа и концентрирования драгоценных металлов, проверенные в полупромышленных масштабах. Они отличаются компактностью, отсутствием незавершенного производства и обеспечивают высокие технико-экономические показатели. Важно отметить, что для всех рассмотренных процессов, как правило, не требуется применение специальных типов оборудования. Во всех случаях могут быть использованы существующие отечественные экстракторы и реакторы, выполненные из титана.
Токсикологические исследования сульфидов и сульфооксидов, позволяют считать данные реагенты умеренно токсичными, которые не требуют специальных мер безопасности.
