Содержание страницы
Биомедицинские имплантаты, состоящие из природных или производных материалов, все чаще используются для замены или улучшения функционирования различных биологических структур.
Среди стареющего населения остеоартрит является очень распространенной проблемой, приводящей к значительному ухудшению состояния здоровья. Биоимплантаты в виде заменителей суставов служат важнейшим методом лечения, обеспечивающим значительное улучшение качества жизни. Спортивные травмы у молодых спортсменов могут привести к замене суставов. Эта потребность в замене и реабилитации суставов стала одной из основных движущих сил для непрерывных исследований и разработок в области биоматериалов для биомедицинских имплантатов.
Сердечно-сосудистые заболевания также требуют применения биоматериалов, особенно в случае сосудистых трансплантатов, стентов и кардиостимуляторов. Биомедицинские имплантаты часто используются в стоматологии, офтальмологии, черепно-лицевой, пластической и реконструктивной хирургии, ветеринарии и медицине (рис. 1).
Область биоматериалов не нова и насчитывает 4000 лет. В ту эпоху египтяне и римляне использовали лен вместо шовного материала. Они также использовали золото и железо в различных стоматологических целях, но не подозревали об осложнениях, связанных с коррозией. Пионерские открытия в области происхождения и эволюции биоимплантатов были сделаны такими исследователями, как Harold Ridley, Paul Winchell, Per- Ingvar Branemark, Otto Wichterle, и John Charnley.
После Второй мировой войны появились и постепенно начали использоваться различные другие материалы, такие как нейлон, тефлон, силикон, нержавеющая сталь и титан. В настоящее время для изготовления биоимплантатов широко используются такие материалы, металлы, полимеры, керамика и композиты.
«Биосовместимость долговременного имплантируемого медицинского устройства — это способность устройства выполнять свою функцию с желаемой степенью интеграции в организм хозяина, не вызывая при никаких нежелательных местных или системных эффектов». Поэтому приемлемость для человеческого организма является главным условием для использования любого материала в качестве биоматериала. Имплантационный материал, помещаемый в организм человека не должны вызывать никаких негативных последствий, таких как аллергические реакции, воспаление или токсичность, как сразу после имплантации, так и в послеоперационный период.
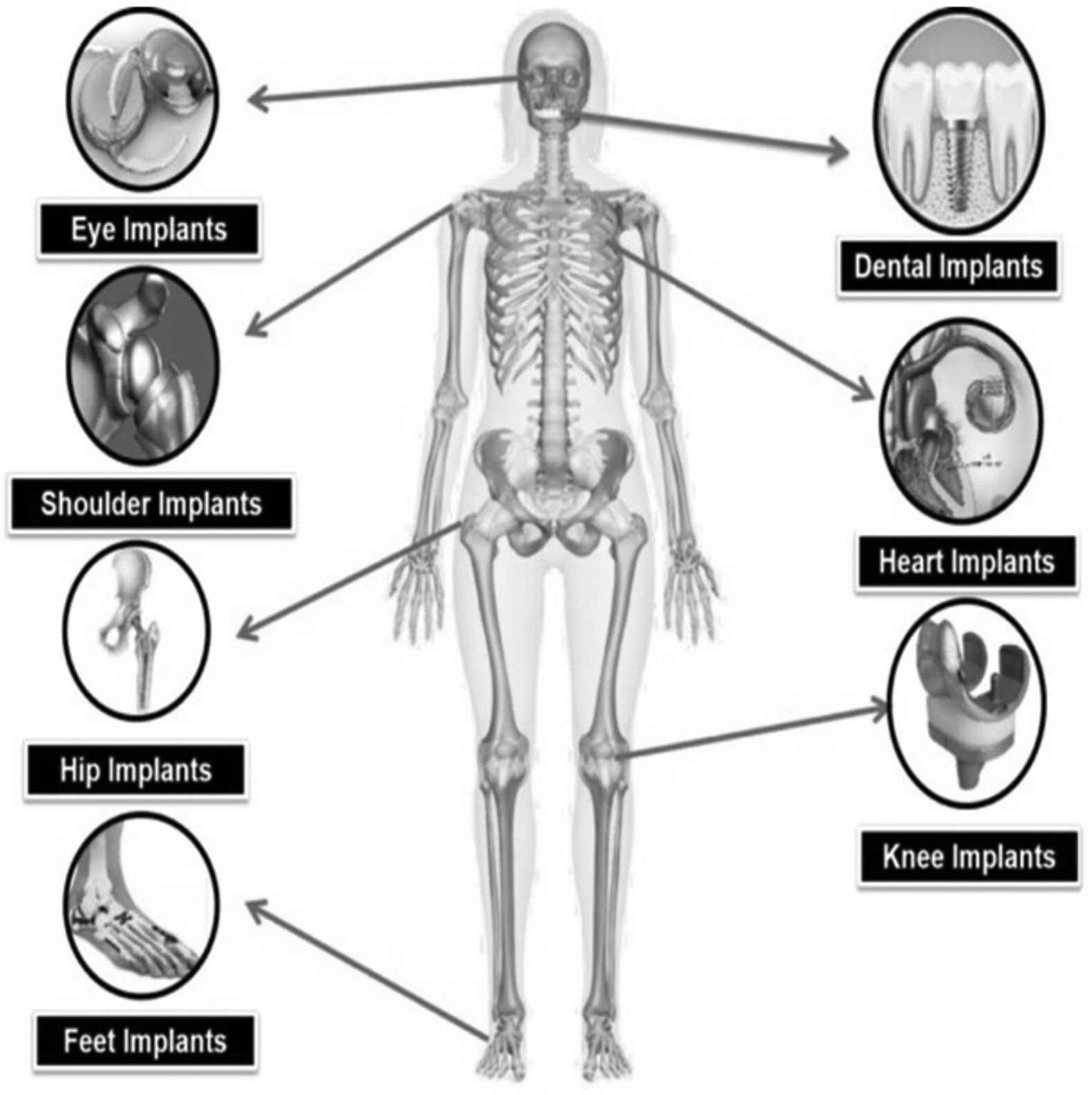
Рисунок 1. Различные области применения биомедицинских имплантатов.
Другим наиболее желательным свойством биоматериалов является то, что они не должны подвергаться разрушению и обладать достаточной механической прочностью, чтобы выдерживать нагрузки, которым они подвергаются. Кроме того, биоматериал должен обладать высокой коррозионной и износостойкостью в условиях чрезвычайно агрессивной среды организма, а также механической прочностью и вязкостью разрушения. Биоматериалы также должны обладать свойствами, позволяющими им сохранять жизнеспособность в течение длительного периода . Это ограничивает сложности, связанные с их заменой.
1. Свойства биоматериалов
Учитывая необходимость обеспечения жизнеспособности в соответствии с описанными выше факторами, биоматериалы для биомедицинских имплантатов должны тщательно подбираться с учетом четырех основных типов свойств:
- объемные свойства,
- свойства поверхности,
- химические свойства,
- трибологические свойства.
1.1. Объемные свойства
Прочность на излом, предел текучести, модуль упругости и ползучесть — основные свойства биоматериала, которые необходимо тщательно оценить, прежде чем использовать его в качестве несущего материала для имплантатов твердых тканей.
1.1.1. Модуль упругости
Модуль упругости определяет жесткость или негибкость материала. Биоматериалы с модулем упругости, сравнительно близким к модулю упругости кости, должны быть выбраны для максимального однородного распределения напряжения на поверхности имплантата, также для предотвращения соответствующего движения в месте соединения имплантата с костью.
1.1.2. Прочность на растяжение, сжатие и сдвиг
Прочность на растяжение — это максимальное усилие, которое материал может выдержать при растяжении, прежде чем подвергнется необратимой деформации. Прочность на сжатие измеряет способность материала сопротивляться сжатию. Биоматериал должен обладать высокой прочностью на растяжение и сжатие, чтобы предотвратить поломку и улучшить устойчивость в процессе использования. Эти свойства помогают поддерживать низкие напряжения в имплантате даже при увеличении передачи нагрузки.
1.1.3. Предел текучести
Предел текучести определяет максимальное напряжение, при котором происходит переход материала из упругого в пластичный. Высокий предел текучести означает, что биоматериал может выдерживать высокие напряжения при циклическом нагружении без хрупкого разрушения.
- Пластичность: Пластичность — критическое свойство для механического соответствия материала. Желательно, чтобы биоматериал обладал высокой пластичностью для контурирования и придания формы при использовании в качестве биомедицинского имплантата.
- Твердость: Твердость определяет пригодность биоматериала для различных клинических применений. Желательно, чтобы имплантируемый биоматериал обладал твердостью, равной твердости кости. С увеличением твердости биоматериала повышается его износостойкость, что увеличивает срок его службы.
1.2. Поверхностные свойства
1.2.1. Поверхностная энергия и поверхностное натяжение
Поверхностное натяжение жидкости и поверхностная энергия соединяемых деталей определяют степень смачивания материала клеем. Чем меньше поверхностное натяжение, тем больше смачиваемость и лучше адгезия остеобластов.
1.2.2. Шероховатость поверхности
Изменение размера частиц зерна и шероховатости поверхности биоимплантата влияет на механические свойства, износостойкость и коррозионную стойкость, а также на биосовместимость. Ультрамелкое зерно обладает более сильными механическими свойствами по сравнению с крупнозернистыми биоматериалами. Это обусловлено тем, что ультрамелкозернистые частицы имеют больше поверхностных атомов, что увеличивает поверхности имплантата и улучшает прикрепление клеток к кости. Поверхности имплантатов классифицируются по различным характеристикам, таким как грубость или шероховатость поверхности, текстура и ориентация неровностей, как описано ниже.
1. В соответствии с шероховатостью поверхности, Веннерберг и соавторы классифицировали поверхности имплантатов как
- Минимально неровная (0,5-1 м).
- Промежуточно неровный (1-2 м).
- Грубый (2-3 м).
2. В зависимости от текстуры поверхности имплантатов можно разделить на следующие категории
- Вогнутая текстура, которая в основном создается с помощью аддитивной обработки, такой как плазменное напыление титана и покрытие гидроксиапатитом (HA).
- Выпуклая текстура, которая в основном создается с помощью субтрактивной обработки, такой как травление и абразивная обработка.
3. В соответствии с ориентацией неровностей поверхности, поверхности имплантатов могут быть классифицированы как
- Изотропные поверхности.
- Анизотропные поверхности.
1.3. Xимические свойства
Коррозия определяется как разрушение металла в результате реакции с окружающей средой. Она влияет на продолжительность периода эксплуатации, а также на срок службы имплантатов, состоящих из металлов и сплавов. Устойчивость к коррозии — важнейшее требование для успешного применения биоматериалов, особенно при использовании их в качестве биомедицинских имплантатов при переломах и замене костей. Ниже список различных видов коррозии.
1.1. Щелевая коррозия
Щелевая коррозия — это форма локальной коррозии, которая происходит в основном в узких областях. Она возникает в местах контакта, например, на границе металл-металл или металл-неметалл. В случае с имплантатами она возникает в основном в области соединения винта имплантата с костью. При щелевой коррозии, когда пассивный слой разрушается из-за снижения pH и уровня кислорода и увеличения хлорид-ионов, начинается коррозия.
1.2. Точечная коррозия
Питтинговая коррозия также является локализованным типом коррозии, которая возникает в имплантате, даже если он имеет небольшие поверхностные ямки или отверстия. При этом типе коррозии высвобождаются ионы металла, которые затем соединяются с хлорид-ионами, инициируя коррозию. Питтинговую коррозию трудно обнаружить, так как маленькие ямки покрыты продуктами коррозии. Она также приводит к шероховатости поверхности имплантата из-за образования ямок.
1.3. Гальваническая коррозия
Гальваническая коррозия происходит, когда один металл корродирует раньше другого, погруженного в тот же проводящий раствор. Примером может служить зубной протез, где никель и хром могут просачиваться в околоимплантационные ткани через выделение слюны в месте соединения имплантата с его надстройкой. Этот процесс влияет на долговечность имплантата и может привести к его поломке.
1.4. Электрохимическая коррозия
Электрохимическая коррозия возникает, когда два разных металла находятся в электролитической среде. В случае биомедицинских имплантатов жидкости организма выступают в качестве электролита и инициируют сопряженные реакции окисления и восстановления, приводящие к разрушению металла, а также переносу заряда через электроны. Большинство имплантируемых металлов, включая кобальт хром, нержавеющую сталь и титан, теряют электроны в растворе и, таким образом, имеют высокий потенциал коррозии.
1.5. Клинические последствия коррозии
Развитие технологий позволило использовать металлические имплантаты в виде винтов, штифтов, пластин, искусственных суставов и кардиостимуляторов; однако, несмотря на постоянные разработки и исследования, ни один биоматериал для имплантатов не защищен от коррозии. Поэтому в этой области ведутся исследования по разработке биоматериалов для имплантатов, не подверженных коррозии, так как коррозия может привести к шероховатости поверхности и ослаблению реставрации, что в конечном итоге приведет к поломке имплантата и воспалению, деградировавшими продуктами.
1.6. Трибологические свойства
Трибологическое поведение биоматериала является одним из критических факторов, определяющих его долговечность при имплантации в систему организма. Трибологические свойства коррелируют с фрикционным износом и смазкой биомедицинских имплантатов, поскольку такое фрикционное поведение между имплантатом и костной поверхностью влияет на срок службы имплантата.
2. Классификация биоматериалов
2.1. Классификация биоматериалов по их происхождению
Исходя из происхождения, различные типы биоматериалов подразделяются на синтетические (например, металлы, полимеры и керамика) и биологические (например, коллаген, шелк, хитозан и альгинат). (Рисунок 2.).
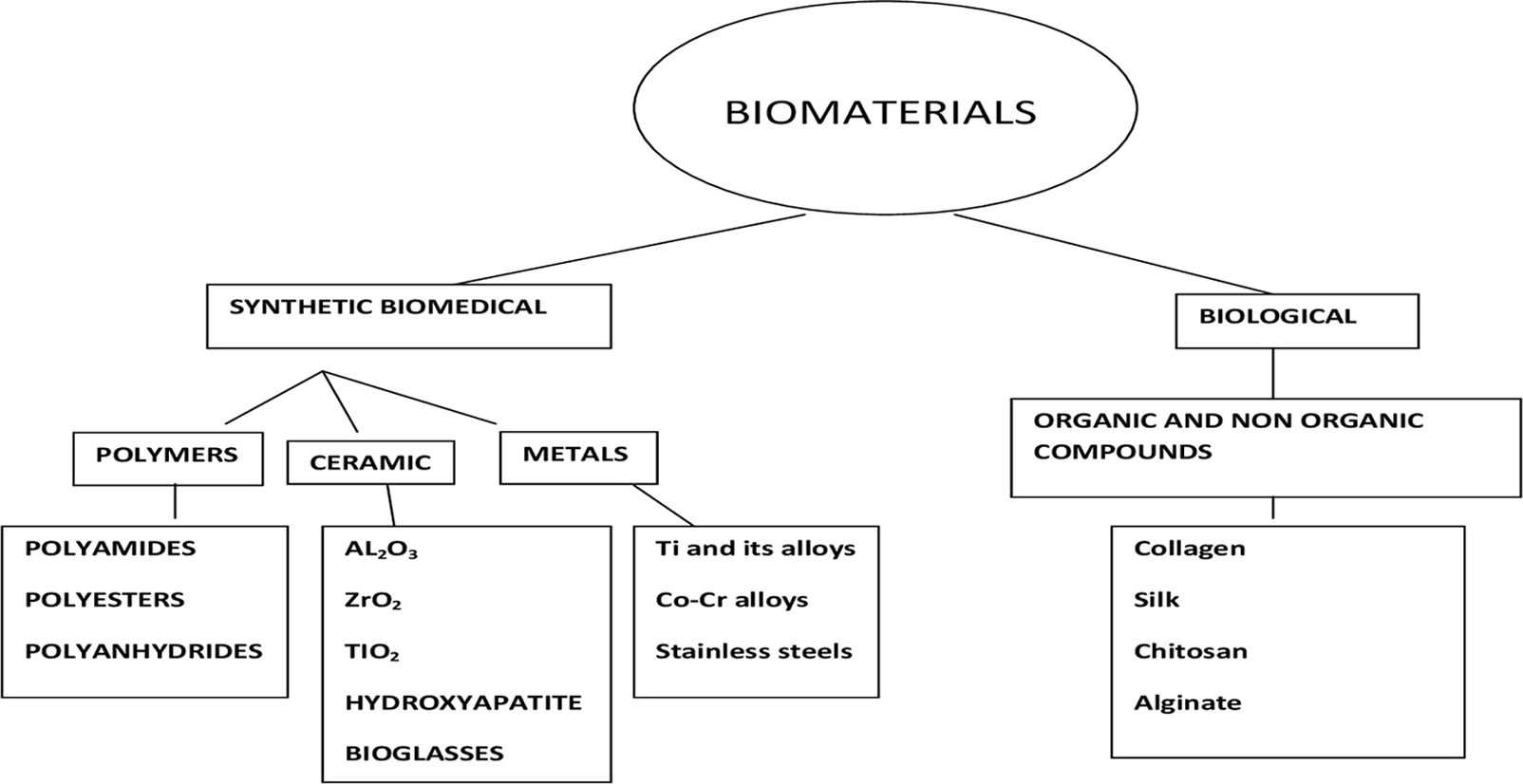
Рисунок 2. Классификация биоматериалов по их происхождению.
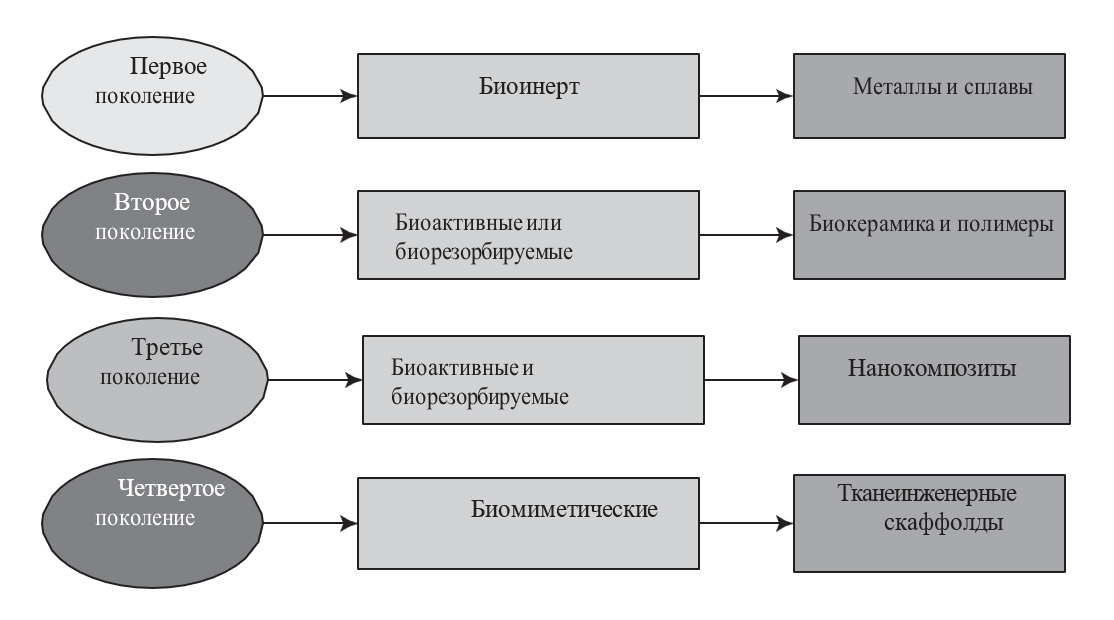
Рисунок 3. Классификация биоматериалов по их биологической активности.
2.2. Классификация биоматериалов по их биологической реакции
- Первое поколение (биоинертные материалы): После размещения в организме человека биоинертные материалы имеют минимальное взаимодействие или химическую реакцию окружающими тканями и структурами.
- Второе поколение (биоактивные материалы или остеокондуктивные материалы): Также известны как остеокондуктивные материалы, они способствуют формированию костной ткани на своей поверхности, действуя как скаффолд через процесс ионного обмена с тканями.
- Третье поколение (биоактивные и биорезорбируемые): Состоят из нанокомпозитов, которые способствуют формированию костной ткани и подвергаются резорбции, чтобы заменить себя в качестве аутологичной ткани.
- Четвертое поколение (биомиметические): Эти материалы представляют собой искусственные синтетические материалы, которые имитируют естественные биологические ткани. Они способны адаптироваться к динамичным условиям окружающей среды (рис. 3.).
3. Типы биоматериалов
3.1. Металлические биоматериалы
Металлические имплантаты являются наиболее часто используемыми биоматериалами для замены суставов и приобретают все большее значение. Спрос на заживление костей путем внутренней фиксации привел к огромному развитию металлических имплантатов и их клинического применения.
Эти металлические материалы обладают превосходными свойствами, такими как высокая прочность, высокая вязкость разрушения, твердость и биосовместимость.
Для изготовления биомедицинских имплантатов ортопедического назначения чаще всего используются такие металлы, как нержавеющая сталь, магний, титан и титановые сплавы.
- Нержавеющая сталь: Нержавеющая сталь — это сплав, состоящий из железа (70%), хрома (16%-18%), никеля (10%-14%) и углерода (1%). Нержавеющая сталь 316L — один из самых популярных биоматериалов для производства биомедицинских имплантатов. Она обеспечивает недорогое решение с хорошими механическими свойствами и биосовместимостью, поэтому широко используется в медицинской промышленности. Несмотря на основные преимущества, применение нержавеющей стали становится ограниченным, поскольку она подвержена коррозии в хлоридной среде и выделяет ионы никеля и хрома, которые оказывают вредное воздействие на организм человека. Нержавеющая сталь также обладает ограниченной гибкостью и поэтому легко подвержена деформации. Поэтому, несмотря на то, что нержавеющая сталь является перспективным биоматериалом для медицинских имплантатов, ее лучше использовать в качестве переходного или временного имплантата. Из-за склонности к коррозии постоянные имплантаты не следует изготавливать из нержавеющей стали. В будущем необходимо провести исследования для улучшения коррозионной стойкости и повышения пластичности нержавеющей стали.
- Магний: Биомедицинские имплантаты на основе магния обладают естественной биостойкостью и сравнительно меньшим модулем упругости, как у кости. Он также обладает такими характеристиками, как высокое отношение прочности к весу или удельная прочность, низкая плотность и хорошая биосовместимость, поэтому может считаться перспективным заменителем постоянных имплантатов. Однако маг-незий подвергается высокой скорости коррозии в среде с уровнем pH от 7,4 до 7,6, и поэтому его механическая целостность снижается до того, как кость заживет. Для решения этой проблемы используются некоторые методы, такие как легирование и обработка поверхности, чтобы контролировать скорость биодеградации.
- Титан: Титан и его сплавы повсеместно используются при медицинских и стоматологических имплантатов благодаря своей превосходной биосовместимости и свойству образовывать стабильный оксидный слой, повышая тем самым коррозионную стойкость. Таким образом, титан и его сплавы используются во многих областях, таких как искусственная замена суставов, фиксация костей, нейрохирургия, имплантация пальцев ног, имплантация вставных глаз и замена зубов. Титан также обладает прекрасным свойством остеоинтеграции, тем самым увеличивая структурную и функциональную связь между живой костью и поверхностью искусственного имплантата, несущего нагрузку. Несмотря на все эти преимущества, поломки имплантатов
В некоторых случаях может возникнуть аллергическая реакция: крапивница, экзема, боль, некроз и потеря костной массы.
3.2. Биомедицинское применение металлов
Металлы для биомедицинских целей выбираются в зависимости от типа применения. Нержавеющая сталь 316L находит широкое применение, включая изготовление черепных пластин, стоматологических имплантатов, стентов и катетеров. Однако для биомедицинских целей, требующих лучшей коррозионной и износостойкости, выбирают кобальто-хромовые сплавы.
В таблице 1 представлены различные металлы для имплантатов и их соответствующие биомедицинские применения.
3.3. Полимеры и композиты
Полимерные биоматериалы, такие как полиальфа-гидроксиэфиры полимолочной кислоты, полигликолевая кислота (PGA) и их сополимеры (PLGA), широко используются в хирургии и медицине.
По сравнению с другими биоматериалами, полимеры обладают низкой прочностью и модулем упругости, но величина модуля упругости приближается к таковой у мягких тканей.
Полимерные композиты обладают лучшими механическими свойствами по сравнению с чисто полимерными материалами. Их главное преимущество заключается в том, что они позволяют человеческим клеткам прилипать к ним очень , что очень важно для регенерации тканей.
Различные полимерные композиты, такие как полиэтилен, полиэфирный эфир кетона, нано-гидроксиапатит и керамические биоматериалы, получили широкое распространение благодаря своей высокой прочности.
Таблица 1. Обзор различных металлов для имплантации и их соответствующих биомедицинских применений
| Подразделение | Применение имплантата | Тип используемого металла |
| Сердечно-сосудистые | Стент
Искусственный клапан Кардиостимулятор |
Нержавеющая сталь 316L Кобальт-хромовые сплавы Титан |
| Ортопедия | Фиксация костей (пластины, винты, штифты)
Искусственные суставы Спинномозговые стержни |
Нержавеющая сталь 316L Титан, титановые сплавы Кобальт-хромовые сплавы |
| Стоматология | Зубные имплантаты | Нитинол из нержавеющей стали 316L |
| Краниофациальные | Пластины и винты
Реконструкция орбиты Краниальные пластины |
Нержавеющая сталь 316L Титан, титановые сплавы Кобальт-хромовые сплавы |
| Оторинология | Искусственная барабанная перепонка | Нержавеющая сталь 316L |
4. Керамика (Биокерамика)
Керамика — это пористый материал на основе стекла, широко используемый в ортопедии и стоматологии. Керамика — инертный материал, обладающий высокой твердостью, высокой температуро- и износостойкостью; однако из-за низкой прочности она очень хрупкая.
Цирконий и глинозем — наиболее широко используемые керамические оксиды для биомедицинских целей, таких как замена суставов и тотальное эндопротезирование тазобедренного сустава, поскольку они обладают превосходной биосовместимостью и износостойкостью. С течением времени проводились исследования, направленные на улучшение свойств керамики путем разработки нанокомпозитов и микросистем.
Нанокомпозиты демонстрируют превосходную биосовместимость, остеокондуктивность и механическую прочность, что делает их перспективным биоматериалом для применения в медицине в будущем.
Типичные свойства, связанные с различными классами биоматериалов, приведены в таблице 2.
Таблица 2. Свойства различных биоматериалов
| Свойства | Полимеры | Металлы и сплавы | Керамика |
| Температура плавления | Низкая | Промежуточная | Высокая |
| Химическая стабильность | Плохо | Хорошо | Очень высокая |
| Электропроводность | Очень низкая | Высокая | Очень низкая, но переменная |
| Теплопроводность | От очень низкой до средней | Высокая | Низкая |
| Свойства и преимущества |
|
|
|
| Механическая деформация | Очень высокая | Высокая (вязкая) | Низкая (хрупкая) |
| Недостатки | Термически нестабилен
Низкая прочность |
Высокая степень износа
и коррозии |
Высокая хрупкость
Высокая плотность |
Заключение
Широкий спектр биоматериалов был разработан на основе их свойств и биомедицинского применения. Правильный выбор биоматериалов, основанный на клинических показаниях, определяет их клинический успех и продолжительность службы. Традиционные биоматериалы, такие как нержавеющая сталь, магний, титан и кобальт-хром, широко используются, но из-за их различных ограничений, таких как низкая коррозионная стойкость, несоответствие модуля упругости и низкая износостойкость, постоянно ведутся работы по улучшению их свойств путем нанесения поверхностных покрытий или использования нанотехнологий для разработки новых и более совершенных материалов.

