Содержание страницы
Благородные металлы серебро (Ag), золото (Au) и металлы платиновой группы — рубидий (Ru), радий (Rh), палладий (Pd), осмий (Os), иридий (Ir), платина (Pt). Некоторые источники относят в этот список так же и ртуть (Hg). Основным достоинством этих металлов по сравнению с другими металлами является их высокая химическая устойчивость в различных средах и в первую очередь в отношении образования кислородных соединений, обусловленная высоким электрохимическим потенциалом. Именно поэтому данные металлы и получили свое название.
Практическое применение находят как чистые металлы — золото, серебро, платина, так и их славы, несмотря на относительно малое распространение их в природе и сравнительно высокую стоимость. Благородные металлы и сплавы на их основе обладают разнообразием физико-химических и механических свойств, а также особыми свойствами (химическая устойчивость, сопротивление коррозии и электрокоррозии, тепло- и электропроводность, катализ, отражательная способность, магнитный гистерезис, термоэлектродвижущая сила и др.). В металлургии золота большую роль играют сплавы золота с ртутью, в металлургии серебра — сплавы серебра со свинцом и тройные сплавы: серебро — свинец — цинк.
Из благородных металлов и сплавов на их основе изготавливают припои, электроконтакты, термосопротивления, термопары, фильтры для искусственного волокна, постоянные электромагниты, потенциометры, нагреватели лабораторных печей, химическую посуду, медицинский инструмент, зубные протезы, катализаторы, ювелирные, наградные и другие изделия промышленного и бытового назначения.
Все благородные металлы (кроме золота и серебра) имеют высокую температуру плавления, высокий удельный вес, не имеют аллотропических превращений (кроме родия — Rh), очень пластичны (кроме родия — Rh и осмия — Os).
Большинство благородных металлов образуют друг с другом однородные твердые растворы, которые в отдельных случаях устойчивы вплоть до низких температур (Ag–Au), в иных случаях распадаются при охлаждении с образованием металлических соединений (Cu2Au, CuAu, Au2Hg, CuHg2, TiAg, CuZn3, AgZn3, AgCd3, AgMg3, Ag5Al3 и др.) или переходят в упорядоченное состояние (Cu–Pt, Cu–Au).
Благородные металлы в порядке возрастания химической устойчивости в различных средах (табл. 1) могут быть расположены в следующем порядке: серебро, палладий и осмий (наименее устойчивы) и иридий (наиболее устойчив).
Таблица 1. Благородные металлы в порядке возрастания химической устойчивости в различных средах
| Металл | Тип кристаллической
решетки |
Плотность,
кг/м3 |
Температура
плавления, °С |
Твердость НВ | Температура окисления
на воздухе, °С |
| Ru | Г12 | 12200 | 2450 | 2000 | 100 |
| Rh | К12 | 12400 | 1960 | 550 | 600 |
| Pd | К12 | 12200 | 1550 | 300 | 600–800 |
| Ag | К12 | 10600 | 960,5 | 200 | Не окисляется |
| Os | Г12 | 22500 | 2700 | 3500 | Комнатной |
| Ir | К12 | 22400 | 2443 | 1600 | 600–700 |
| Pt | К12 | 21600 | 1769 | 300 | Не окисляется |
| Au | К12 | 1960 | 1063 | 180 | Не окисляется |
Все благородные металлы (серебро, золото, рутений, родий, палладий, иридий, осмий и платина) в настоящее время считаются мономорфными.
1. Золото
Золото — металл желтого цвета, кристаллическая ГЦК решетка с периодом а = 0,40786 нм, полиморфизмом не обладает. Плавится при температуре 1063 °C (табл. 1), плотность при 20 °C равна 19320 кг/м3.

Прочностные характеристики чистого золота имеют не высокие значения: σ0,2 = 10–25 МПа; σв = 120–130 МПа; HB = 220–250. Воздействие холодной пластической деформацией позволяет увеличить прочностные характеристики Au приблизительно в 2 раза. Из 1 грамма золота можно вытянуть проволоку длиной около 1 км или изготовить фольгу толщиной 0,0001 мм, которая в проходящем свете приобретает зеленоватый оттенок.
Золото быстро корродирует в растворах I, Br, KCN, кроме того, хорошо растворяется в ртути, образуя амальгаму.
Наиболее вредными примесями в золоте являются Pb, Te и Bi. Свинец практически не растворим в золоте и образует с ним химические соединения Au3Pb и AuPb2, которые резко снижают пластические свойства. При содержании Pb в золоте, не превышающем 0,005 %, приводит к выделению соединений по границам зерен. Теллур также практически не растворим в золоте и при содержании его не более чем 0,01 %, выделяется по границам зерен и оказывает вредное влияние на обрабатываемость золота и сплавов на его основе. Висмут в небольшом количестве, не превышающем 0,001 %, приводит к охрупчиванию, несмотря на ограниченную его растворимость в золоте. Кроме того, Sb, Fe, Sn, Si неблагоприятно влияют на технологические свойства Au, и их процентное содержание строго лимитировано.
Все примеси снижают электропроводность и коррозионную стойкость золота и сплавов на его основе. Данное обстоятельство особенно важно для микроэлектроники.
Золото характеризуется высокой отражающей способностью в середине видимой части спектра, достигая коэффициента отражения R = 98 % (см. рис. 1), который сохраняет высокие значения и в инфракрасной области (ИК). Такой характер спектра отражения объясняет насыщенный цвет золота и является основанием того, что металл используется для экранирования космических аппаратов и оптики от ИК излучения, а также для защиты от действия радиоактивных источников. Оптические свойства золота интересны, т. к. дают разнообразные цветовые композиции. Как было отмечено, золото обладает золотисто-желтым цветом и сильным металлическим блеском. В дисперсном состоянии в проходящем свете — зеленоватый цвет, в виде тончайших листков в проходящем свете — зеленоватый или голубовато-зеленоватый, в расплавленном состоянии — зеленый, пары золота зеленовато-желтого цвета.
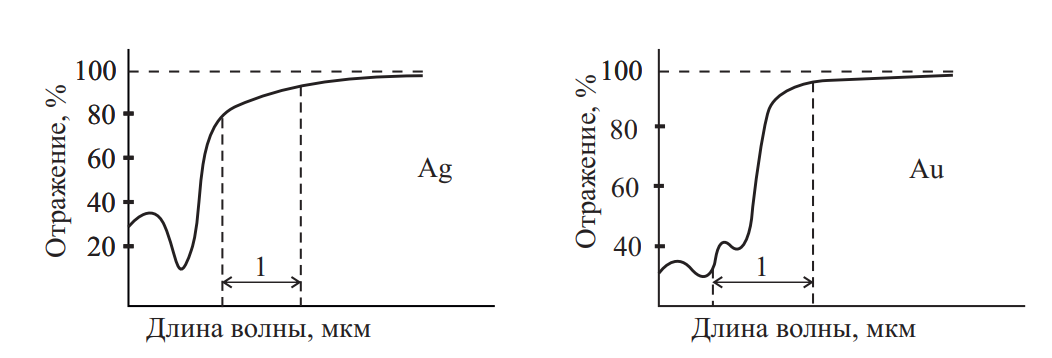
Рис. 1. Отражательная способность серебра и золота: 1 — видимая часть спектра
Золото дает со многими металла химические соединения, обладающие различной окраской. Соединения AuAl2 (78,5 % Au и 21,5 % Al) имеют фиолетово-пурпурный цвет, AuZn2 — синий цвет, Au2Na — светло-желтый, AuK — оливково-зеленый цвет, Au2K — фиолетовый цвет. С рубидием золото образует аурид Au2Rb темно-зеленого цвета. Чтобы ювелирные изделия служили дольше, лучше блестели и сопротивлялись царапинам, к золоту с давних времен добавляли другие металлы — серебро, медь, цинк и т. д., называемые лигатурой. В зависимости от качества и количества добавок цвет золота меняется от белого до черного, но золото при этом остается золотом.
Известно, что сплавы серебра с медью имеют серебристо-белый цвет и сильный блеск. С увеличением количества меди цвет сплавов переходит к желтому (70 % Ag) от темного к бледно-красному (50 % Ag), затем к красному (30 % Ag) (рис. 2).
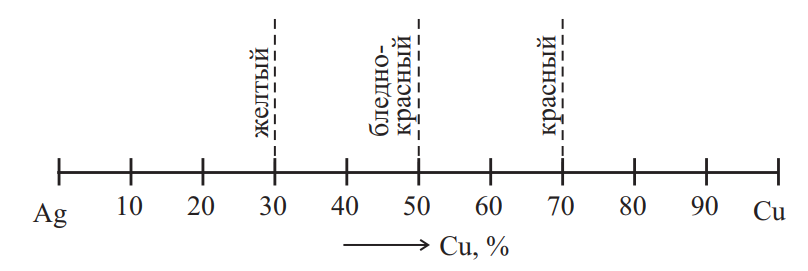
Рис. 2. Изменение цвета сплавов серебро-медь
В сплавах золото-серебро-медь цвет изменяется постепенно от золотисто-желтого (золото) до серебристо-белого (серебро) и красного (медь); от ярко-красного (золото с медью) до светло-зеленого (золото с серебром) (рис. 3).
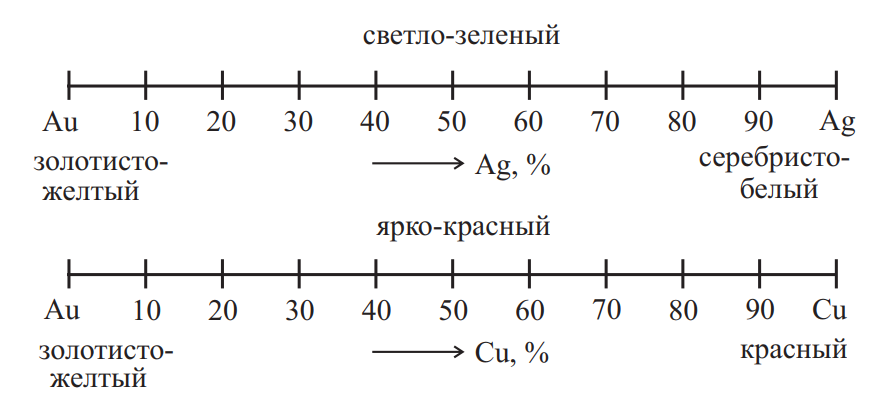
Рис. 3. Изменение цвета сплавов золото-серебро-медь
Добавка до 12 % палладия (или равноценное по объему количество платины) в золото и золотые сплавы (в том числе с медью) уничтожает практически полностью специфический для золота (и меди) цвет, придавая им оттенок, характерный для платиновых металлов (рис. 4).
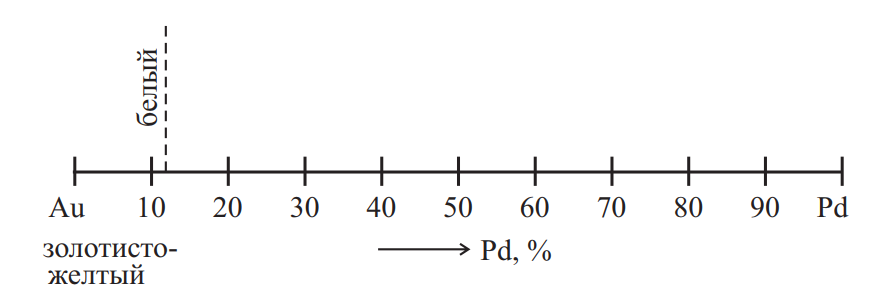
Рис. 4. Изменение цвета сплавов золото-палладий
Золото растворяется в «царской водке» (смеси концентрированных кислот HCl и HNO3) и растворе цианистого калия, быстро разрушается в горячих смесях серной и азотной кислот и серной кислоты с окислами тяжелых металлов. Золото частично растворяется при кипячении в азотной кислоте и выше 250 °С в присутствии кислорода в серной кислоте. Чистое золото стойко в кислороде, сере, сернистом ангидриде и селене.
Золото, химически восстановленное из разных растворов, имеет различный вид и цвет (черное золото, коричневое золото и т. п.). Различные виды золота могут быть получены восстановлением сернистой кислоты хлорного, хлористого, бромного, бромистого или йодистого золота. Черное золото можно получить растворением золота в амальгаме натрия под водой с последующим подкислением соляной кислотой. Коричневое золото хорошо растворяется в азотной и соляной кислотах. При растворении в горячей соляной кислоте и последующим охлаждении образуются кристаллы обычного золота.
О количестве примесей в золотом сплаве можно судить по клейму, обозначающему пробу. Чаще всего в ювелирном производстве используется золото 585 пробы. Это индекс метрической системы определения пробы драгоценного металла, принятой в России. Он означает процентное содержание благородного металла в 1000 частей сплава. Если на золотом изделии стоит проба 750, это означает, что сплав содержит 75 % чистого золота и 25 % лигатуры. В металлах с указанной пробой соотношение серебра и меди может быть разное. В 585 пробе соотношение Cu и Ag около 1:1 отнимает цвет золота.
В метрической системе применяются следующие пробы: 1000, 958, 900, 750, 585, 500, 375, 333. Из них ювелирными считаются 750, 585, 375. Изделия из золота с пробой ниже 375 относятся к бижутерии. Из золота 900 пробы раньше делали зубные протезы. Во многих странах Европы и в США используется другая — каратная система определения проб. Ювелирные изделия бывают в 6,8,10,12,14 и 18 каратов. Самая распространенная — 14-каратная проба соответствует нашей 585-й метрической пробе (табл. 2). К сведению: один карат равен 0,2 грамма.
Таблица 2. Данные соответствия метрической, каратной и золотниковой проб
| Метрическая проба | Золотниковая проба | Каратная проба |
| 583/585 | 56 | 14 |
| 750 | 72 | 18 |
| 958 | 95 | 23 |
Карат — главная ювелирная метрическая единица — получила название в честь семян тропического дерева цератонии: эти семена не меняют своего веса при высыхании, в старину их использовали для взвешивания драгоценных камней и золота.
Антикварные изделия, выпущенные в России до 1926 года, тоже маркировались не так, как сегодня, а по золотниковой системе, в которой индекс пробы означает количество золотников в фунте (453,6 г.) металла. Например, золотой сплав 56 пробы содержал 56 золотников чистого золота и 40 золотников других металлов, а один фунт был равен 96 золотникам. Эта проба в 56 золотников была самой популярной и тоже соответствует 585-й пробе золота.
Первичное золото выпускается в виде слитков (ГОСТ 28058–89). В зависимости от чистоты рафинированное золото выпускается 4 марок (табл. 3)
Таблица 3. Маркировка рафинированного золота
| Показатели | Значения | |||
| Марка | ЗлА-1П* | ЗлА-1 | ЗлА-2 | ЗлА-3 |
| Au, %, не менее | 99,99 | 99,99 | 99,98 | 99,95 |
*Au марки ЗлА-1П обладает повышенной чистотой по Pt, Pd, Cu и др.
Вес золотого слитка составляет 1150–1300 г. Слиток предназначается для производства сплавов, банковского хранения и межгосударственных расчетов.
Деформированные полуфабрикаты, полученные из литых заготовок, могут быть использованы как проводники в виде микропроволоки диаметром 10–60 мкм; в виде покрытий на стекле, керамике, кварце; в электронных устройствах; в виде элементов полупроводников и в микросхемах.
Ленты, фольга, полосы используются в качестве коррозионно-стойких, защитных покрытий (стенки химических реакторов, куполов культовых сооружений). Трубки применяются для перекачки жидкостей в дозирующих устройствах и т. д. Из золота также изготавливают анодные пластины.
По ГОСТ 6835–2002 определяются марки золота и его сплавов технического назначения. Наименование марок сплавов на основе золота состоит из букв, обозначающих компоненты сплава: Зл — золото, Ср — серебро, Пл — платина, Пд — палладий, М — медь, Ц — цинк, Н — никель. Следующие за буквами цифры указывают номинальное содержание компонентов благородных металлов в сплаве в процентах. Например, сплав ЗлСрМ58,5–20 содержит 58,2–25,8 % Au; 19,5–20 % Ag и остальное Cu.
ГОСТ 30649–99 устанавливает марки золота и сплавов на основе благородных металлов, применяемых для изготовления ювелирных, ритуально-обрядовых и др. изделий бытового назначения. В стандарте наименование марки сплавов состоит из букв, обозначающих компоненты сплава и цифр, указывающих номинальное содержание легирующих элементов в тысячных долях (пробы), если компонент — благородный металл, и в процентах, если компонент не благородный металл. Например, сплав ЗлСрНЦМ-585–80–8,2–2,5 содержит 58,5–59 % Au, 7,5–8,5 % Ag, 8,2 % Ni, 2,5 % Zn и остальное — Cu.
Золото в чистом виде применяется в относительно небольших количествах в медицине, для покрытий и различных контактов. Температуру плавления золота принимают за постоянную точку при градуировании пирометров. Температура плавления золота является высшей точкой температурной шкалы, точно проверенной и установленной экспериментально. Это связано с тем, что золото может быть получено весьма высокой чистоты, при плавлении не загрязняется окислами и не изменяет температуру кристаллизации.
Основная часть потребляемого в промышленности и в быту золота используется в виде сплавов. Наиболее широкое применение имеют золотые сплавы в ювелирной промышленности: двойные и тройные сплавы с медью и серебром, а также с добавками платины, палладия, цинка, олова и др.
Сплавы золота — медь — серебро — платина и золото — серебро — кадмий — цинк применяют в зубопротезной практике. Золотые сплавы используют для изготовления электротехнических контактов, обмоток сопротивления потенциометров, фильер для стекловолокна.
Ювелирных изделий из чистого золота не бывает, т. к. оно мягкое, легко царапается и совершенно теряет товарный вид.
2. Серебро
Серебро — металл белого цвета, кристаллическая решетка ГЦК (см. табл. 1), параметр решетки а = 0,40779 нм. Температура плавления серебра — 960 °C, плотность — 1050 кг/м³ при температуре 20 °C. Серебро легко растворяется в концентрированной азотной и нагретой серной кислотах. Действие азотной кислоты усиливается с повышением температуры. Серебро имеет повышенную стойкость в холодных растворах органических кислот, не загрязняет и не изменяет окраски фенола, фруктовых соков, эфирных масел, вина и многих фармацевтических препаратов.

Ионы серебра (так называемая серебряная вода) имеют сильное бактерицидное действие. Тускнение и потеря отражательной способности серебра на воздухе связаны с присутствием сернистых соединений (наряду с влагой и кислородом) и образованием пленки Ag2S.
В чистом виде применяется в качестве покрытия столовых приборов, контактов и некоторых изделий химической промышленности. Значительное количество серебра расходуется на производство светочувствительной пленки и бумаги. Основная часть серебра используется в виде сплавов. В качестве материала для серебряных монет употребляются сплавы серебра с медью. В ювелирном производстве применяются сплавы золота и серебра с медью для повышения твердости сплавов и одновременно удешевления их. Известно, что серебряные украшения быстро темнеют вследствие окисления. В настоящее время производят серебро с покрытием очень тонким слоем родия, при этом цвет и блеск серебра сохраняется.
При добавлении в бронзу небольшого количества серебра при литье колоколов усиливается мелодическая составляющая звона.
Сплавы на основе серебра маркируют так же, как и сплавы на основе золота. Сплавы технического назначения на серебряной основе обозначают буквами и следующими за ними цифрами, показывающими номинальное содержание легирующего элемента в процентах. Например: СрПд20–80, СрПдМ50–30 (Ag = 50 %, Pd = 30 %, Cu = 20 %).
Сплавы на основе серебра, используемые для бытовых и ювелирных изделий, маркируются буквами и цифрами в долях (пробах), если легирующим элементом является благородный металл, и в процентах, если легирующий элемент не благородный металл. Например, сплав СрМ875 содержит 87,5 % Ag, остальное медь.
3. Платина
Платина — белый блестящий металл. Кристаллическая решетка ГЦК с параметром решетки а = 0,39160 нм. Плавится при температуре 1769 °C, плотность при 20 °C составляет 21500 кг/м3.
Платина (от исп. plata — «серебришко») является редким металлом и ее мировые запасы весьма ограничены. При этом потребность в ней с каждым годом увеличивается вдвое.

С точки зрения химических и электрохимических свойств платина в соединениях двух- и четырехвалентна. Электродный потенциал в кислом растворе Pt ↔ Pt2+2еравен при 25 °С +1,2 В. Величина электрохимического эквивалента четырехвалентной платины равна 1,821 г/А·г.
Платина весьма устойчива к действию различных химически активных веществ. При нагревании на воздухе платина не изменяется. Газы, содержащие углерод (метан, этилен, окись углерода), не воздействуют на платину. При нагревании платины в атмосфере аммиака она чернеет вследствие отложения на поверхности платиновой черни.
Платина в компактном виде (проволока, листы, лента) в виде черни и в коллоидном состоянии является достаточно активным катализатором ряда химических реакций. Не снижает ее каталитического действия добавка никеля, а вот кобальт, алюминий и висмут значительно уменьшают. Добавка меди, серебра, олова и железа полностью уничтожает это действие.
Платиновая чернь при нагревании до 700–800 °С переходит в губчатую платину, она активно поглощает водород и при нагревании на воздухе загорается.
При сплавлении платины в небольших дозах с золотом и серебром не изменяется цвет основного металла.
Чистая платина используется:
- для изготовления платиновой посуды, сеток и катодов для электролиза, филер, проволок для обмотки печей электросопротивления и термопар, проволок для термометров сопротивления;
- в химической промышленности (платиновая чернь, губчатая платина, коллоидная платина и т. п.) в качестве катализатора при производстве серной и азотной кислот, в окислении аммиака, при изготовлении некоторых витаминов, в реакциях дегидрогенизации спиртов, гидрогенизации, восстановлении и т. п.;
- для платинирования и плакирования различной химической посуды и резервуаров, ювелирных изделий в целях повышения химической стойкости;
- в ювелирной промышленности со времен Древнего Египта. Чистая, редкая, вечная — этими эпитетами награждают один из самых необычных драгоценных металлов — платину.
Современные дорогие автомобили оснащаются глушителями с платиновыми катализаторами, обезвреживающими выхлопные газы. При этом единственными надежными катализаторами, известными на сегодняшний день, являются платина и палладий (Pd).
Более разнообразно и широко применяется платина в сплавах. Например, в пирометрии в паре с чистой платиной применяются сплавы с 10 % родия (Rh) или иридия (Ir). Сплавы платины с иридием, имеющие повышенную твердость, применяются для фильер в производстве искусственного шелка.
Кроме того, сплавы на основе платины применяются:
- в электропромышленности для изготовления контактов, вакуумных приборов, электропечей сопротивления, электродов, проволоки для термопар и пирометрических приборов, в химической промышленности в качестве катализатора, для изготовления химической посуды и различной аппаратуры, фильтров, сеток;
- в медицинской промышленности и зубоврачебном деле для изготовления игл, шприцев, коронок, мостов, крючков и т. п.
Количество платины в сплавах колеблется в широких пределах. В качестве других добавок служат металлы платиновой группы (особенно иридий (Ir), родий (Rh) и палладий (Pd), золото (Au), серебро (Ag), медь (Cu), кадмий (Cd), никель (Ni) и др.
Сплавы платины с железом (Fe) и кобальтом (Co) в области упорядочения имеют высокую коэрцитивную силу и остаточную индукцию, которые зависят от режима обработки. Сплавы с максимальной коэрцитивной силой, как магнитожесткие, применяются для изготовления постоянных магнитов точных и малогабаритных измерительных приборов.
В сплавах платины с 40–50 % железа наблюдается отрицательный температурный коэффициент расширения, поэтому они используются для часовых волосков и точных измерительных приборов.
Сплав 90 % Pt и 10 % Rh применяется как материал для термопар (один электрод из этого сплава, другой — из чистой платины). Из-за большой электродвижущей силы и высокой окалиностойкости такая термопара может работать до 1700 °С.
В прецизионных измерительных и автоматических управляемых приборах имеются потенциометры с обмоткой из благородных сплавов (например, проволока из сплава платины с 25 % иридия или сплава платины с 30–40 % серебра и др.).
Для электрических контактов различных ответственных аппаратов используют сплавы благородных металлов из-за их большой стойкости против испарения и окисления (сплавы Pt + Ir, Pt + W, Pd + Ag и др.) Высокой твердостью и износостойкостью в сочетании с очень высокой коррозионной стойкостью обладает сплав Os–Ir (осмий-иридий).
Из него делают опорные точки различных измерительных инструментов, иглы компасов, наконечники перьев автоматических ручек.
Первичную платину согласно ГОСТ 12341–81 маркируют ПлА. Сплавы на основе платины маркируют следующим образом: буквенное обозначение легирующих элементов Pd — Пд; Rh — Рд; Ir — И; Ru — Ру и цифры, обозначающие процентное содержание этих легирующих элементов. Например, ПлПдРдРу20–10–1,5 Pd = 20 %, Rh = 10 %, Ru = 1,5 %, остальное Pt.
Механические свойства благородных металлов приведены в табл. 4.
Таблица 4. Механические свойства благородных металлов
| Показатели | Ag | Au | Ru | Rh | Pd | Os | Ir | Pt |
| Модуль упругости, МПа | – | – | 42000 | 28000 | 112000 | 56700 | 53000 | – |
| Коэффициент пуансона | 0,37 | 0,42 | – | – | 0,399 | – | – | 0,39 |
| Модуль сдвига, МПа | 2680 | 2850 | – | – | 4610 | – | – | 6220 |
| Коэффициент сжимаемости
холоднодеформированного металла К·106, МПа |
0,987 | 0,577 | 0,342 | 0,3606 | 0,519 | – | 0,30 | 0,360 |
| Предел пропорциональности металла, МПа | – | – | – | – | 220 | – | – | 180 |
| Предел текучести металла, МПа,
литого холоднодеформированного отожженного |
35
310 55 |
210
30 |
–
– – |
–
– – |
–
– – |
–
– – |
–
– – |
37
185 14–38 |
Влияние легирования платиноидами на твердость платины показано на рис. 5. Влияние легирующих элементов на твердость палладия приведено на рис. 6. Механические свойства благородных металлов в зависимости от температуры нагрева приведены на рис. 7.
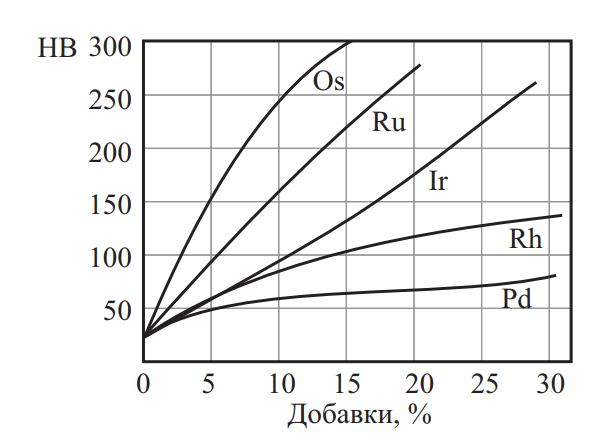
Рис. 5. Влияние легирования платиноидами на твердость платины
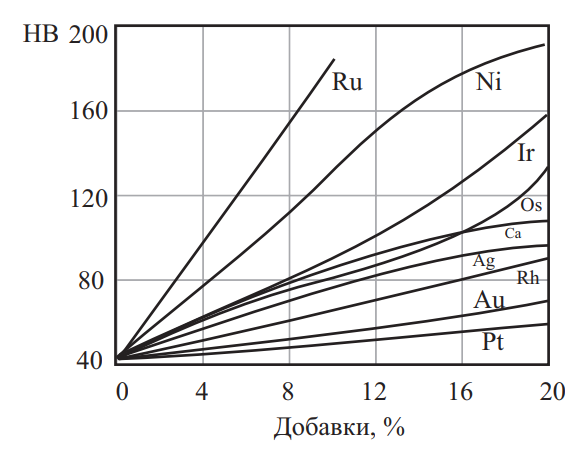
Рис. 6. Влияние легирующих элементов на твердость палладия
4. Обработка и ее влияние на свойства благородных металлов
Изделия из благородных металлов различного назначения получают путем обработки давлением — прокатки, прессования, волочения, свободной ковки, объемной и листовой штамповки. Пластическая деформация позволяет получать различную форму и размеры заготовок. Благородные металлы и сплавы на их основе обрабатываются в холодном и горячем состояниях.
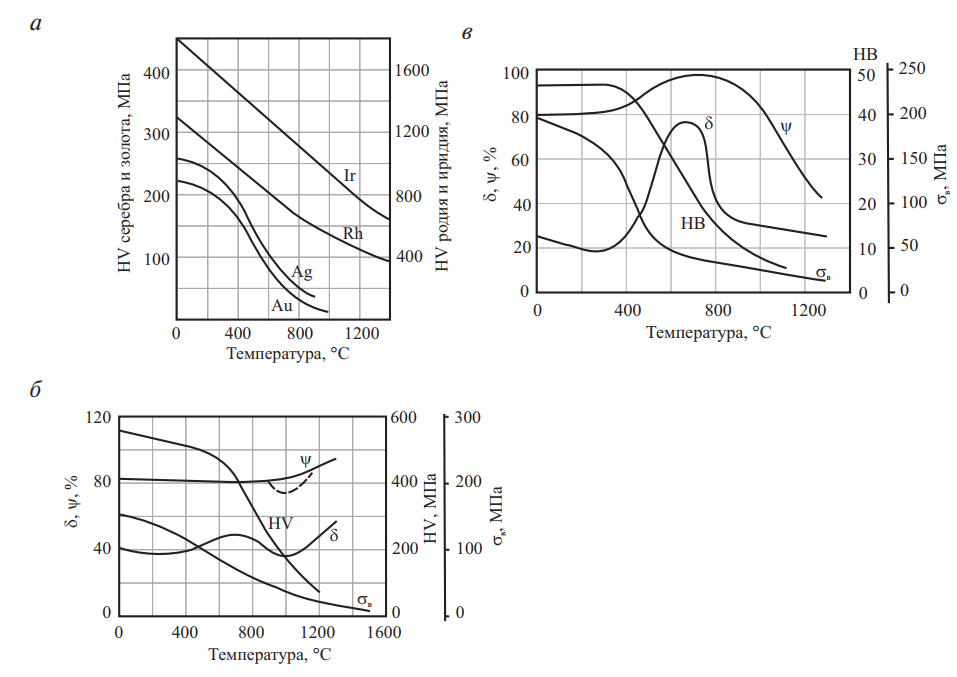
Рис. 7. Механические свойства благородных металлов в зависимости от температуры нагрева: а — серебро, золото, родий, иридий; б — палладий; в — платина
Во время горячей деформации, при нагреве выше порога рекристаллизации, происходит достаточно полная рекристаллизация, но она, как правило, не имеет самостоятельного значения и является предшествующей холодной деформации. Но бывают исключения.
Во время горячей деформации возникает ряд нежелательных явлений, поэтому холодная пластическая деформация является основным этапом процесса производства изделий и полуфабрикатов из благородных металлов и сплавов. При этом обеспечивается высокое качество поверхности, значительная точность геометрических размеров с возможностью получения различных по величине и форме сечений. Величина усилий при холодной пластической деформации определяется показателями сопротивления сдвигу (пределом текучести σ0,2, временным сопротивлением сдвигу σв) и их зависимостью от степени деформации.
Холодную пластическую деформацию обычно проводят с промежуточными отжигами, обеспечивающими разупрочнение. Величину суммарной деформации (от отжига до отжига) выбирают с учетом допустимого упрочнения (повышения сопротивления деформации и снижения пластичности).
На рис. 8 приведены кривые зависимости сопротивления упругой и пластической деформации и характеристик пластичности от степени пластической деформации для чистых металлов.
Используя приведенные данные, можно выбрать необходимую степень деформации, чтобы получить заданную совокупность механических свойств изделия или полуфабриката.
При рекристаллизационном отжиге происходит восстановление физико-механических свойств. Механические свойства металлов в зависимости от температуры рекристаллизационного отжига приведены на рис. 9 и 10.
Обычные технические металлы имеют поликристаллическое строение. При холодной пластической деформации поликристаллического тела происходит ориентировка определенных плоскостей и направлений кристаллов и появляется текстура. При волочении поликристаллических проволок из металлов с кубической гранецентрированной решеткой (серебро, золото, сплавы меди с серебром, палладий, платина) образуется двойная текстура с направлениями, параллельными оси проволоки (см. табл. 5). Распределение между этими направлениями различно.
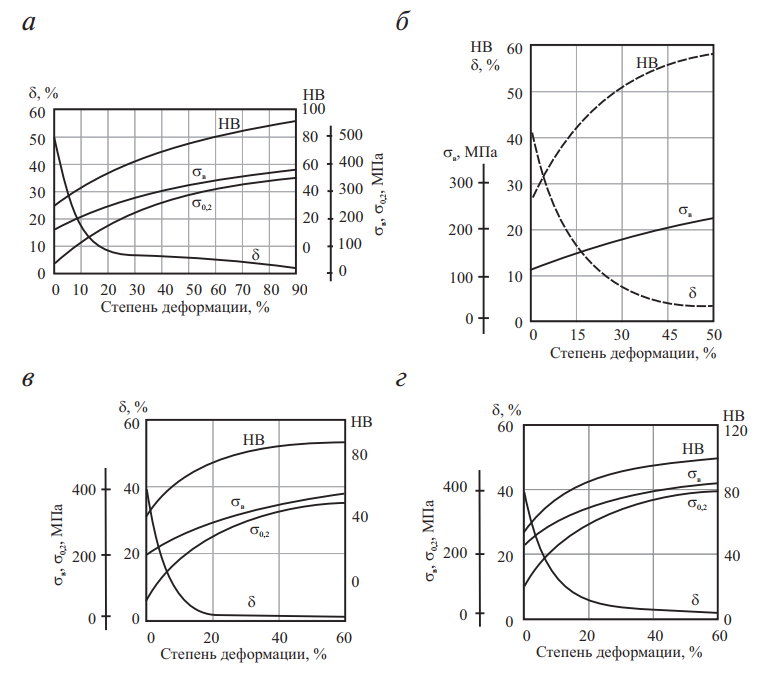
Рис. 8. Механические свойства металлов в зависимости от степени холодной деформации: а — серебро; б — золото; в — палладий; г — платина
Текстура проволоки из эвтектических и других многофазных сплавов при незначительном различии сопротивления деформации фаз образуется в каждой фазе независимо друг от друга в соответствии с ее природой. При значительной разнице в сопротивлении деформации, а следовательно, и интенсивности течения каждой фазы благодаря взаимному влиянию текстура искажается и даже практически может отсутствовать.
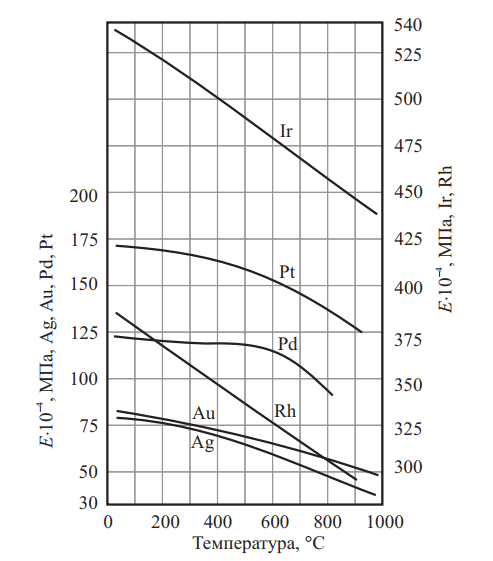
Рис. 9. Модуль Юнга металлов в зависимости от температуры нагрева
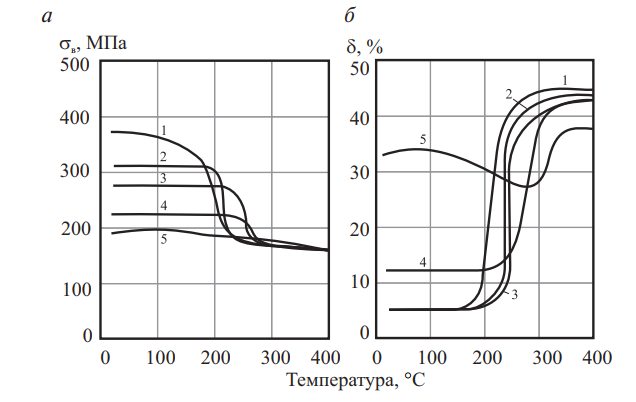
Рис. 10. Механические свойства металлов зависимости от температуры рекристаллизационного отжига: а — серебро; б — палладий; 1 — предварительная степень деформации 96 %; 2 – 60,5 %; 3 – 40,5 %; 4 – 16,5 %, 5–6 %
Таблица 5. Относительное количество ориентированных кристаллов
| Металл | Количество ориентированных кристаллов, % | |
| в направлении [100],
параллельно оси проволоки |
в направлении [111],
параллельно оси проволоки |
|
| Медь | 40 | 60 |
| Золото | 50 | 50 |
| Серебро | 75 | 25 |
Текстура плоской прокатки характеризуется кристаллографическими направлениями и плоскостями, параллельными соответственно направлению и плоскости прокатки.
Металлы с ГЦК решеткой (медь, алюминий, никель, серебро, золото, платина, сплавы золота с серебром) имеют преимущественную ориентировку плоскости типа {100} и направления типа <112>, параллельные соответственно плоскости и направления прокатки. Эта текстура может быть обозначена (100) [112]. При перекрестной прокатке степень упрочнения и соответственно упорядоченности уменьшается. При низкой температуре отжига текстура деформации сохраняется или переходит в новую, например, у прокатанного серебра и сплавов золота с серебром текстура (100) [112] переходит в (113) [211]. При высокой температуре отжига (у серебра при 800 °С) текстура практически полностью уничтожается. При высокой степени деформации (выше 80 %) у золота и других металлов с ГЦК решеткой появляется после высокотемпературного отжига (с сильным ростом величины зерна) так называемая кубическая текстура рекристаллизации (100) [001]. Образование этой текстуры приводит к резкому росту анизотропии, понижению прочности и пластичности и повышению сопротивления коррозии.
Благодаря образованию волокнистой структуры и появлению текстуры создается анизотропия свойств. Данное обстоятельство необходимо учитывать при построении технологии дальнейшей обработки и эксплуатации. В частности, это ведет к неравномерности вытяжки и образованию так называемых фестонов, что вызывает повышенные отходы и может привести к браку. При вытяжке несимметричных изделий анизотропию учитывают при выборе направления осей заготовки относительно направления прокатки. Резко выраженная текстура повышает электропроводность, усиливает магнитные свойства в необходимых направлениях. Сопротивление сжимающим и растягивающим напряжениям больше в направлении волокна, чем поперек, сопротивление срезу больше поперек волокна и меньше вдоль волокна. Появляющаяся текстура ведет к неравномерности электросопротивления в различных направлениях. На величину и особенно на устойчивость электросопротивления сильно влияет структурное состояние металла и сплава, а следовательно, способ и режим термической обработки. При нагреве электросопротивление восстанавливается в процессе возврата (рис. 11)
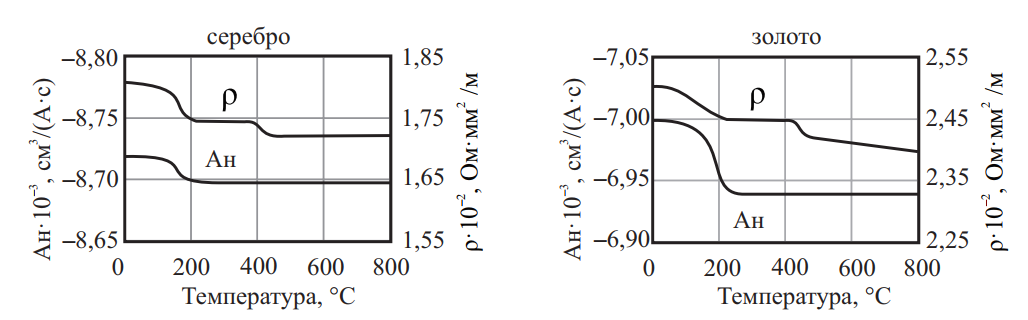
Рис. 11. Зависимость значений электросопротивления от температуры нагрева при отжиге серебра и золота
5. Сплавы благородных металлов
Строение и свойства сплавов, поведение при различных технологических процессах и в условиях эксплуатации определяются их химическим составом, т. е. содержанием заданных компонентов и примесей. Закономерности изменения свойств тесно связаны с типом диаграммы состояния и ее особенностями для каждой системы сплавов. Для выбора состава сплава и конкретного суждения о его свойствах наряду с диаграммой состояния необходимо иметь зависимость свойств (электросопротивления, ТЭДС, твердости, пластичности, теплового расширения и др.) от состава. Для ряда систем диаграммы состояния удобно совмещать с зависимостью свойств от химического состава. Такие диаграммы называются диаграммами физико-химического состояния.
Выбор сплавов, содержащих благородные металлы, во многом определяется их высокой стоимостью и дефицитностью. Наиболее рационально применять благородные металлы и их сплавы для ответственных деталей приборов и других изделий, если требуются особые свойства (или их совокупность), которыми не обладают черные или цветные металлы, сплавы и неметаллические материалы. К числу особых свойств относятся: постоянство удельного электросопротивления, стабильность изменения ТЭДС, магнитожесткость и др.
В табл. 6 представлены справочные данные абсолютной ТЭДС в различных сплавах золота с серебром.
Таблица 6. Абсолютная ТЭДС сплавов Au–Ag ε, мкВ/°С
| Ag, ат. % | Температура, ºС | |||||||||
| 0 | 100 | 200 | 300 | 400 | 500 | 600 | 700 | 800 | 900 | |
| 10 | 0,02 | 0,23 | 0,44 | 0,65 | 0,87 | 1,08 | 1,29 | 1,50 | 1,71 | 1,92 |
| 20 | –0,88 | –0,74 | –0,60 | –0,46 | –0,32 | –0,18 | –0,05 | +0,09 | +0,23 | –0,36 |
| 30 | –1,0 | –1,0 | –1,0 | –1,0 | –1,0 | –1,0 | –1,0 | –1,0 | –1,0 | –1,84 |
| 40 | –1,14 | –1,20 | –1,26 | –1,31 | –1,36 | –1,42 | –1,48 | –1,53 | –1,59 | –1,65 |
| 50 | –1,50 | –1,56 | –1,62 | –1,68 | –1,74 | –1,81 | –1,87 | –1,94 | –2,00 | –2,05 |
| 60 | –1,84 | –1,84 | –1,84 | –1,84 | –1,84 | –1,84 | –1,84 | –1,84 | –1,84 | –1,84 |
| 70 | –1,60 | –1,60 | –1,60 | –1,60 | –1,60 | –1,60 | –1,60 | –1,60 | –1,60 | –1,60 |
| 80 | –1,60 | –1,59 | –1,58 | –1,57 | –1,52 | –1,40 | –1,20 | –0,98 | –0,67 | –0,35 |
| 90 | –1,14 | –1,08 | –1,00 | –0,89 | –0,68 | –0,20 | 0,70 | 1,60 | 2,5 | 3,4 |
Серебро и золото неограниченно растворимы в жидком и в твердом состояниях. Сплавы Au и Ag имеют высокую пластичность при холодной и горячей деформации во всем интервале концентраций (см. рис 12).
Сплавы серебра с медью ограниченно растворимы друг в друге, эвтектическое превращение протекает при температуре 779 °С (см. рис. 13). Эти сплавы при кристаллизации склонны к ликвации. Ликвация значительно усиливается при введении никеля (многокомпонентные серебряные припои). Введение в серебро меди способствует окислению сплава при нагреве как с поверхности, так и во внутренних слоях за счет диффузии кислорода. Возникающие при окислении во время плавки или термической обработке в атмосфере, содержащей кислород, окислы меди резко снижают пластичность сплавов как в холодной, так и в нагретом состояниях, вызывая хладноломкость и красноломкость.
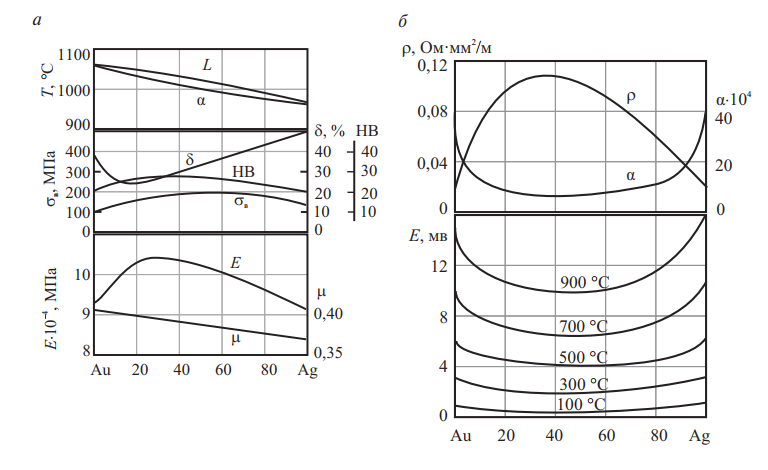
Рис. 12. Система Ag–Au: а — диаграмма состояния, механические свойства, физические свойства; б — удельное электросопротивление и температурный коэффициент удельного электросопротивления, ТЭДС при различных температурах
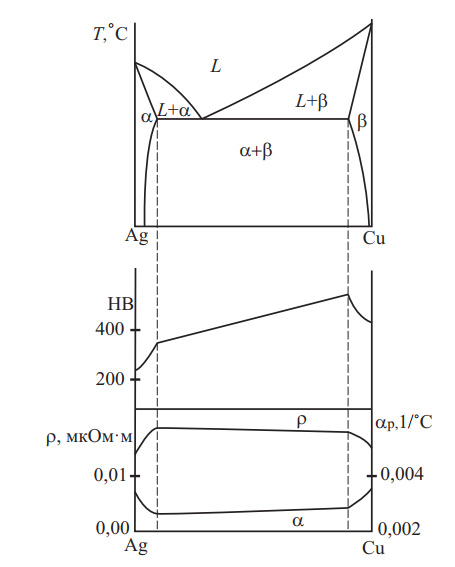
Рис. 13. Система Ag–Сu; диаграмма состояния; твердость HB; удельное электросопротивление ρ и температурный коэффициент удельного электросопротивления α
При нагревании в окислительной атмосфере и последующем отбеливании (особенно многократных) поверхность сплава обогащается серебром. Это используется при эмалировании прозрачными эмалями. Примеси висмута, свинца и сурьмы в сплавах строго ограничиваются, т. к. вредно отражаются на обрабатываемости сплавов вследствие содержания в них меди.
Серебро и сплавы серебра с медью легко паяются (серебренными припоями), свариваются, полируются, давая возможность получения изделий всевозможной формы с сильным блеском (большой отражательной способностью).Механические свойства сплавов системы Cu–Ag приведены на рис. 14.
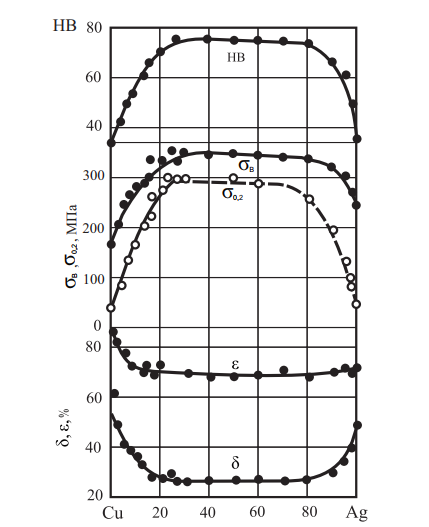
Рис. 14. Механические свойства сплавов системы Cu–Ag после рекристаллизационного отжига при температуре 650 °C
Серебро и палладий неограниченно растворяются друг в друге и после кристаллизации образуют непрерывный ряд твердых растворов. Свойства сплавов системы Ag–Pd после отжига и закалки представлены на рис. 15, температурная зависимость абсолютной ТЭДС — в табл. 7.
Таблица 7. Абсолютная ТЭДС сплавов палладия с серебром, ε, мкВ/°С
| Ag, ат. % | Температура, °С | ||||||||||||
| 0 | 100 | 200 | 300 | 400 | 500 | 600 | 700 | 800 | 900 | 1000 | 1100 | 1120 | |
| 10 | –15,2 | –19,8 | –24,8 | –29 | –34 | –39,1 | –43,3 | –46,8 | –49,3 | –51,3 | –54,1 | –56,2 | –58,0 |
| 20 | –18,2 | –26,3 | –34,0 | –41 | –46 | –5,6 | –54,7 | –58,2 | –60,8 | –62,8 | –64,7 | –66,3 | –67,7 |
| 30 | –24,0 | –34,0 | –43,8 | –52 | –58 | –63,0 | –66,6 | –69,6 | –71,4 | –72,7 | –73,6 | –74,5 | –75,2 |
| 40 | –33,6 | –44,6 | –53,4 | –60 | –66 | –69,5 | –72,4 | –74,8 | –76,8 | –78,2 | –79,7 | –80,2 | –81,5 |
| 50 | –29,4 | 39,0 | –47,3 | –53 | –59 | –62,6 | –65,3 | –67,3 | –68,8 | –70 | 71,2 | –72,3 | –73,5 |
| 60 | –14 | –20,7 | –26,4 | –32 | –37 | –41,2 | –45,4 | –49,4 | –52,8 | –56 | –59 | –62 | –64,8 |
| 70 | –7,4 | –11,8 | –15,8 | –20 | –23 | –25,8 | –28,7 | –31,3 | –33,7 | –36 | –38,2 | –40,2 | – |
| 80 | –6,8 | –8,4 | –10 | –12 | –13 | –15 | –16,6 | –18,2 | –19,8 | –21,5 | –23,2 | – | – |
| 90 | –4,6 | –4,8 | –4,9 | –5 | –5,2 | –5,4 | –5,5 | –5,6 | –5,7 | –5,9 | – | – | – |
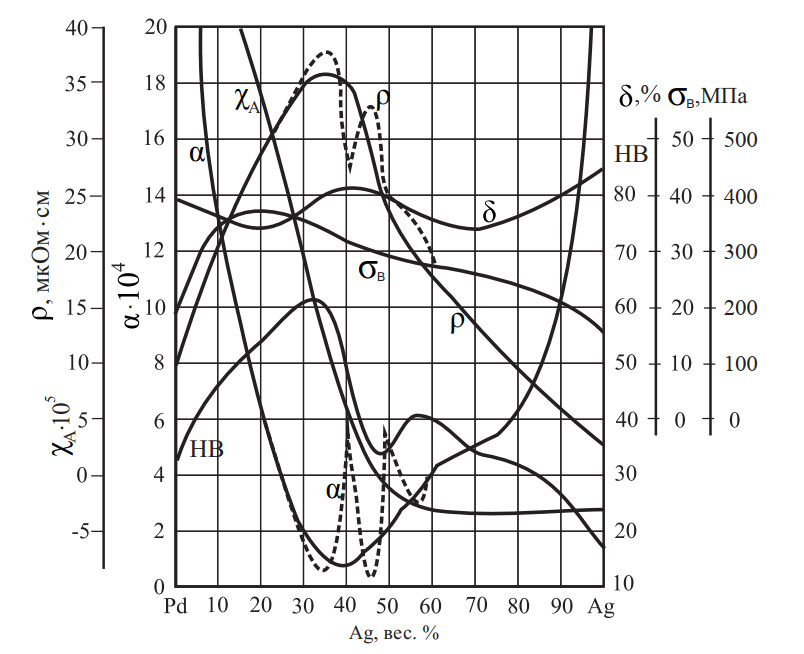
Рис. 15. Свойства сплавов системы Ag–Pd (пунктирная линия — отжиг при 800 °C; сплошная линия — закалка от 1200 °C)
Сплавы серебра с платиной ограниченно растворимы друг в друге, образуя твердые растворы. Диаграмма системы Ag–Pd, а также свойства сплавов представлены на рис. 16. и в табл. 8.
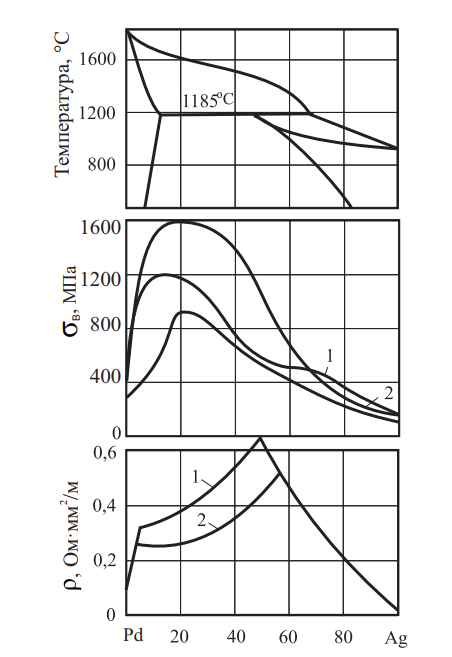
Рис. 16. Диаграмма состояния, временное сопротивление разрыву и удельное электросопротивление; 1 — закалка от 900 °C; 2 — отжиг
Таблица 8. Абсолютная ТЭДС сплавов платины с серебром, ε, мкВ/°С
| Ag, ат. % | Температура, °С | |||||||||
| 100 | 200 | 300 | 400 | 500 | 600 | 700 | 800 | 900 | 1000 | |
| 5 | –5,4 | –8,0 | –9,8 | –10,6 | 0,87 | 1,08 | 1,29 | 1,50 | 1,71 | –20,0 |
| 10 | –5,5 | –8,1 | –9,9 | –11 | –12,9 | –14,5 | –16 | –17,4 | –18,8 | –20,2 |
| 20 | –6,6 | –9,4 | –11,6 | –13,3 | –15,2 | –17,4 | –19 | –20,6 | –22,2 | –23,5 |
| 25 | –7,9 | –10 | –13,4 | –15,4 | –17,3 | –19,7 | –22,1 | –24 | –25,7 | –27,2 |
| 30 | –10 | –13,5 | –16,2 | –18,2 | –20,5 | –23,5 | –26,1 | –28,4 | –30,4 | –32 |
| 40 | –9,2 | –12,7 | –15,5 | –17,6 | –20,1 | –23,3 | –26,1 | –28,4 | –30,4 | –32,1 |
| 50 | –12,5 | –16,2 | –19,5 | –22,1 | –25,2 | –28 | –30,1 | –33,6 | –36,4 | –38,8 |
| 80 | –10,7 | –14,1 | –17,2 | –20,1 | –22,6 | –24,9 | –28 | –31,5 | –35,4 | –40,2 |
| 90 | –7,4 | –9,7 | –11,6 | –13 | –14,4 | –16,2 | –17,9 | –19,1 | –23,2 | |
Золото и медь в жидком состоянии взаимно растворимы в любых соотношениях (рис. 17). При кристаллизации сплава системы Au–Cu образуют непрерывный ряд твердых растворов с точкой минимума при 82 вес. % золота и t = 884 °C и при 80 вес. % золота и t = 889 °C.
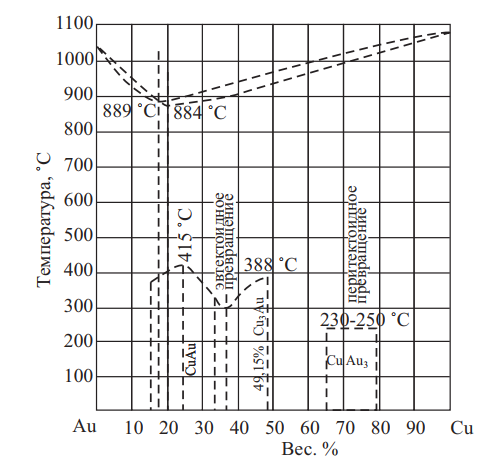
Рис. 17. Диаграмма состояния Au–Cu
Твердый раствор золото-медь имеет решетку гранецентрированного куба. Постоянная решетки изменяется в зависимости от состава аддитивно с незначительным положительным отклонением. При изучении системы Au–Cu академиком Курнаковым Н. С. и его сотрудниками была впервые установлена возможность упорядочения твердого раствора.
С понижением температуры образовавшийся после затвердевания твердый раствор меди и золота претерпевает превращения. На кривых изменения свойств сплавов Au–Cu в твердом состоянии обнаруживаются максимумы, которые соответствуют химическим соединениям Cu3Au (50,85 вес.% Au) и CuAu (75,63 вес.% Au). Причиной этих реакций является тенденция к упорядочению расположения атомов с понижением температуры.
Процесс упорядочения с выделением фазы Курнакова Cu3Au происходит в интервале концентраций от 37,5 до 52,5 % Cu. Область образования фазы Cu3Au ограничена на диаграмме кривой с максимумом при температуре, согласно большинству исследований [Хансен], 388±3 °С. Упорядочение расположения атомов и переход к фазе Cu3Au происходит без изменения типа решетки: решетка ГЦК сохраняется.
Процесс упорядочения с образованием соединения CuAu происходит в интервале концентраций от 15 до 32,5 % Cu. Область образования CuAu ограничена на диаграмме кривой с максимумом при температуре, согласно большинству исследований, 415±10 °С. Упорядочение расположения атомов сопровождается изменением типа решетки и выражается на рентгенограмме, помимо появления сверхструктурных линий, расщеплением части интерференционных линий твердого раствора. Определено, что упорядоченная фаза существует в двух модификациях: AuCuI и AuCuII.
Модификация AuCuI имеет тетрагональную решетку, а структура AuCuII является орторомбической и тесно связана с тетрагональной структурой AuCuI. Переход AuCuII в AuCuI происходит в узком интервале концентраций. Кривая, ограничивающая границы перехода из AuCuII в AuCuI, имеет максимум при температуре 385±10ºС.
На технологию сплавов золота, содержащих медь (двойные, тройные и многокомпонентные), значительно влияет упорядочение в определенных интервалах концентраций. Вне этих интервалов сплавы Au–Cu и Au–Ag–Cu пластичны в горячем и холодном состоянии. Сплавы, в которых происходит упорядочение твердого раствора (Au–Cu и Au–Ag–Cu), необходимо отливать с высокой скоростью охлаждения (кристаллизации). Если упорядочение значительно ухудшает технологические характеристики (например, в области AuCu), то при промежуточной термической обработке с целью повышения пластичности и снижения сопротивления деформации производят закалку.
При термической обработке сплавов Au–Cu и Au–Ag–Cu желательна нейтральная или слабовосстановительная атмосфера (смесь окиси и двуокиси углерода, диссоциированный и неполностью сожженный аммиак, азот, инертные газы, вакуум).
Золото с платиной ограниченно растворимы друг в друге и имеют один тип кристаллической решетки — ГЦК. Диаграмма Pt–Au представлена на рис. 18, а также показано изменение удельного электросопротивления и твердости в зависимости от концентрации компонентов и видов термической обработки.
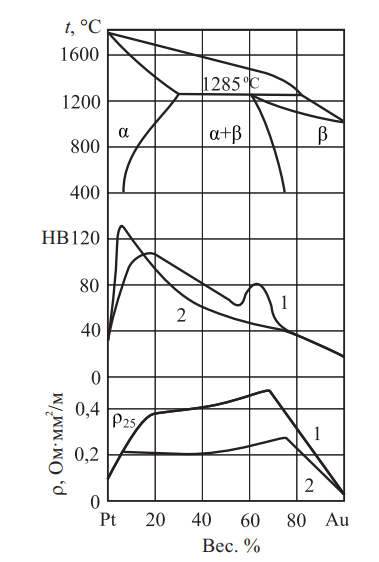
Рис. 18. Диаграмма состояния системы Pt–Au, удельное электросопротивление, твердость по Рудницкому: 1 — закаленные при t = 1000º С; 2 — отожженные
Платина (tпл = 1773,5 °С) с родием (t пл = 1966 °С) образуют непрерывный ряд твердых растворов с очень узким интервалом кристаллизации. Температура плавления сплавов с увеличением содержания Rh повышается (до 25 вес. % Rh) вначале быстро, а затем медленно.
Сплавы платины с родием имеют высокую устойчивость в кислотах, царская водка (67 % HCl и 33 % HNO3) незначительно действует на сплавы с содержанием Rh до 40 ат. % и практически не действует при большем содержания родия. Сплавы при получении азотной кислоты из аммиака являются более активными катализаторами, чем чистая платина.
С увеличением содержания родия обрабатываемость давлением ухудшается, сплавы с 30 % Rh и более практически не поддаются обработке давлением.
Сплавы, содержащие более 5 % родия, при нагревании в интервале от 750 до 1150 °С окисляются. Сплавы, нагретые до температуры
1200 °С и выше и быстро охлажденные на воздухе или в воде, имеют неокисленную поверхность, т. к. окислы родия диссоциируют.
Платина и палладий имеют однотипные кристаллические решетки (ГЦК) с близкими по величине параметрами и образуют непрерывный ряд твердых растворов. При введении палладия температура плавления сплавов уменьшается. Кроме того, палладий в сплаве снижает термостойкость платины, ее химическую устойчивость и сопротивление коррозии.
Сплавы, содержащие до 25 вес. % Pd, не растворяются в кипящей азотной кислоте и не окисляются при нагревании. Сплавы Pt-Pd имеют высокую пластичность в горячем и холодном состоянии и обрабатываются по технологии, аналогичной технологии обработки чистых металлов.
Платина и железо неограниченно растворимы друг в друге. Из твердого раствора выделяются три фазы Н. С. Курнакова: Fe3Pt, FePt и FePt3.
Фазы Fe3Pt и FePt ферромагнитны, фаза FePt3 — парамагнитна. Сплавы с 80–93 ат. % Pt проявляют ферромагнетизм при охлаждении до –100 °С. Термоэлектрические свойства сплавов аналогичны свойствам сплавов Fe–Ni (инвар). Сплавы, применяемые для постоянных магнитов, и другие упорядочивающиеся сплавы подвергаются холодной прокатке и волочению после закалки при 1200–1300 °С.
6. Тройные системы сплавов
Серебро–золото–медь. Диаграмма состояния тройных сплавов и горизонтальные сечения при различных температурах приведены на рис. 19 и 20.
После кристаллизации большая часть концентрационного треугольника занята тройным твердым раствором, кроме области, примыкающей к области механической смеси диаграммы серебро-медь. Образование зон Н. С. Курнакова AuCu и AuCu3 определяется соотношением золота и меди, а Au3Cu аналогично двойной системе золотомедь. Добавление серебра в сплавы с содержанием AuCu до 5 ат. % ведет к снижению критической точки — порядок — беспорядок примерно на 60 °С. При температуре отпуска 360–380 °С превращение происходит полностью. После отпуска при 360–380 °С образуется AuCuII, а при 300 °С — AuCuI. При дальнейшем увеличении содержания серебра превращение также протекает, но твердый раствор преобладает над сверхструктурой. В сплавах, содержащих более 30 ат. % серебра, превращение порядок — беспорядок практически отсутствует. Введение серебра в сплавы с соотношением AuCu3 практически не изменяет температуру превращения. Свойства сплавов системы приведены на рис. 21–23.
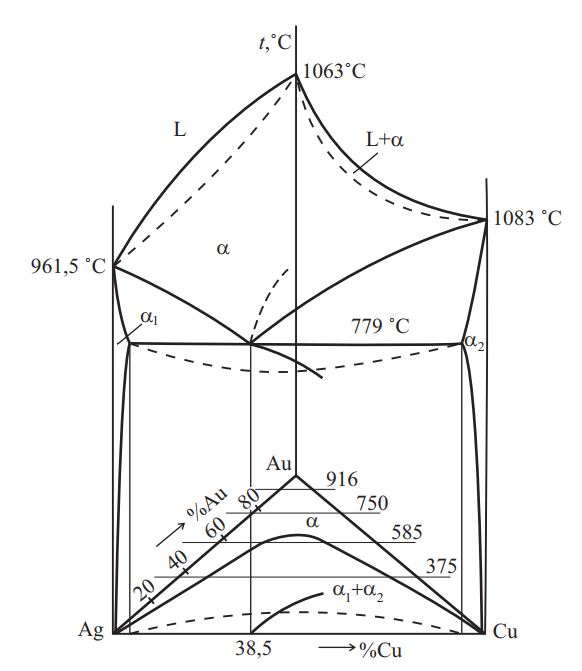
Рис. 19. Диаграмма состояния системы Au–Ag–Cu
Рис. 20. Изотермические сечения в системе Ag–Au–Cu при различных температурах
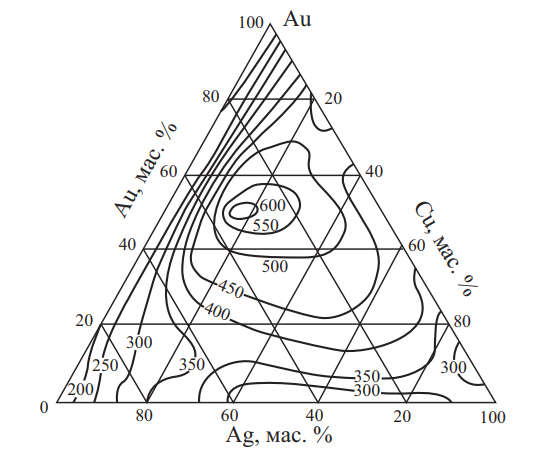
Рис. 21. Изменение временного сопротивления разрыву σв сплавов системы Au–Ag–Cu при комнатной температуре
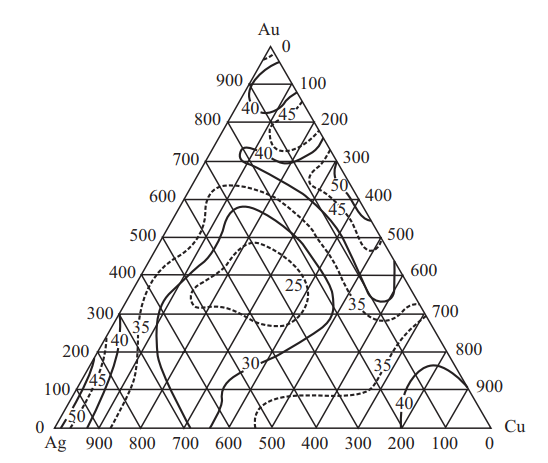
Рис. 22. Изменение относительного удлинения δ, %, сплавов системы Au–Ag–Cu при комнатной температуре
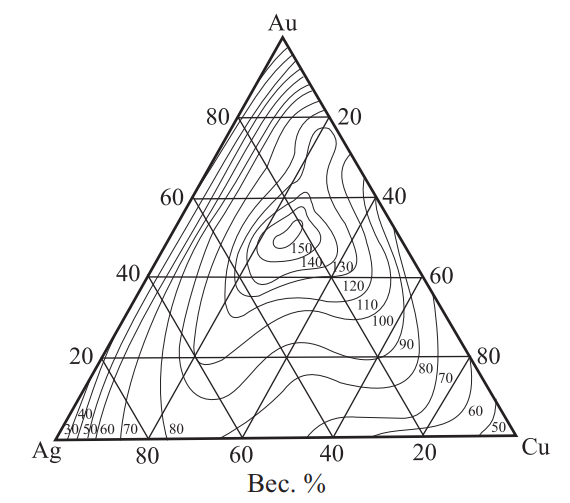
Рис. 23. Изменение твердости по Бринеллю НВ сплавов системы Au–Ag–Cu при комнатной температуре
Согласно рис. 24 и 25 наилучший комплекс механических свойств имеют сплавы, содержащие 58,5 % золота.
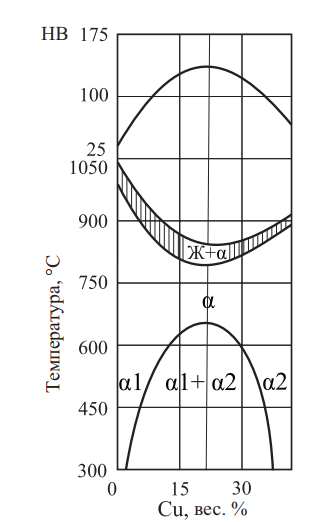
Рис. 24. Политермический разрез и твердость по Бринеллю при содержании Au = 58,5 %
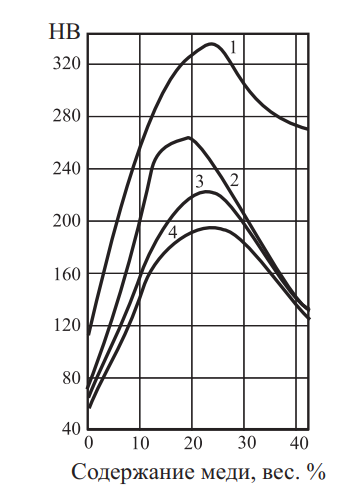
Рис. 25. Твердость сплавов, содержащих 58,5 % золота в различных состояниях: 1 — деформированное; 2 — отжиг при 600 °C; 3 — отжиг при 700 °C; 3 — закалка от 650 °C
7. Особенности производства сплавов
Серебро и серебряные сплавы плавят в высокочастотных печах, горнах и электрических печах сопротивления. Плавку ведут в графитовых тиглях при условии отсутствия платиновых металлов, железа, кобальта и никеля в значительных количествах. При плавке серебра и серебряных сплавов (без летучих компонентов) рекомендуется восстановительная атмосфера: смесь окиси и двуокиси углерода. Для этого используют уголь в качестве покровного флюса. Литье производится с направленной кристаллизацией и высокой скоростью охлаждения в изложницах с открытой стенкой. Многокомпонентные сплавы с высокой жидкотекучестью (припои) можно отливать в чугунные изложницы с естественным охлаждением.
Серебро на воздухе при нагревании не окисляется, но незначительно растворяет кислород. Сплавы с содержанием более 2–3 % цинка, кадмия и других аналогичных по свойствам компонентов отжигают в слабоокислительной или окислительной атмосфере.
Золото и золотые сплавы плавят на том же оборудовании, что серебро и серебряные сплавы. Золото не растворяет водород и не взаимодействует с ним и незначительно растворяет кислород. Атмосфера и флюсы при плавке определяются свойствами легирующих компонентов. При плавке тройных сплавов золото-серебро-медь применяют покров из угля (восстановительная атмосфера из смеси окиси и двуокиси углерода).
Сплавы серебра и золота ответственного назначения с повышенными требованиями к содержанию примесей и особенно газов плавят и отливают в вакууме, а при наличии летучих компонентов и особенных требований к стабильности химического состава — в эвакуированных кварцевых ампулах.
Золото легко сваривается любыми методами и паяется золотыми припоями без флюса. Золотые сплавы паяются золотыми припоями, хорошо полируются, давая изделиям с сильным блеском разнообразные цвета и оттенки (в зависимости от содержания меди и серебра).
Платину, палладий и сплавы на их основе плавят в высокочастотных печах. Платина, палладий и сплавы на их основе, содержащие другие платиновые металлы, а также серебро, железо, никель, кобальт, имеют низкие литейные свойства, склонны к сильному поглощению газов, что ведет к снижению и нестабильности физико-механических свойств и появлению поверхностных дефектов (плен, пузырей и т. п.). В связи с этим плавка и литье этих металлов связаны с усложнением технологического процесса и необходимостью очень тщательного его соблюдения.
Плавку и литье в наиболее ответственных случаях (в частности, сплавов платины с родием) ведут в вакууме.
При плавке и литье сплавов с платиной, палладием, серебром и никелем необходимо предотвращать поглощение кислорода и других газов, а при производстве слитков сплавов, содержащих палладий, кобальт и особенно никель, — серы.
Сплавы благородных металлов в зависимости от их свойств и назначения подвергают различным видам обработки давлением как в горячем, так и холодном состоянии. Отличительными особенностями сплавов на основе платины и палладия по сравнению со сплавами на основе серебра и золота являются их вязкость и высокий коэффициент трения при пластической деформации. Это ведет к тому, что при обработке давлением происходит налипание металла на инструмент, а трудоемкость обработки резанием, шлифовки и полировки значительно увеличивается. Для снижения коэффициента трения и предохранения от налипаний в некоторых случаях поверхность заготовки покрывают медью, а если медь нежелательна, то серебром. Положительные результаты дает введение (раскисление) кадмия, если это допустимо по техническим требованиям к продукции.
Холодная деформация из-за накопления остаточных напряжений вызывает по сравнению с равновесным рекристаллизованным состоянием повышение растворимости в агрессивных средах и понижение сопротивления коррозии. Несмотря на достаточно высокую химическую стойкость, в ряде случаев может происходить коррозионное растрескивание деформированных (неотожженных) изделий из сплавов драгоценных металлов. К числу таких сплавов относятся сплавы золото-медь и золото-серебро-медь. Места концентрации остаточных напряжений на полуфабрикатах и изделиях из этих сплавов, практически не подвергаясь общей коррозии, растрескиваются при контакте с ртутными соединениями, парами соляной кислоты, концентрация которых может быть сравнительно невелика. Холодная деформация ускоряет процесс распада твердых растворов, ведет к разрушению дальнего порядка в расположении атомов. Так, сплав состава AuCu3 в упорядоченном состоянии (фаза Н. С. Курнакова) после холодной деформации с обжатием более 60 % становится разупорядоченным.
Промежуточную продукцию, готовые полуфабрикаты и изделия подвергают различным видам термической обработки: отжигу, закалке и отпуску. Термическая обработка в сочетании с пластической деформацией создает широкие возможности для получения заданных физико-химических и механических свойств (магнитных характеристик, электросопротивления, ТЭДС, величины зерна, модуля упругости и др.).
При применении холодной деформации по сравнению с горячей достигается большая стабильность свойств. Наиболее распространена термическая обработка с целью разупрочнения после холодной деформации: она может быть промежуточной для снятия упрочнения после предыдущей холодной деформации (прокатки, волочения, штамповки и т. п.) и возможности дальнейшей обработки и окончательной для полуфабрикатов и изделий, выпускаемых в мягком состоянии. Чистые металлы и сплавы в виде твердых растворов, в которых при нагревании до температур разупрочнения не происходит превращений, подвергают отжигу первого рода. Наряду с рекристаллизацией в некоторых случаях для готовых полуфабрикатов применяют низкотемпературный отжиг (возврат). В этом случае прочностные характеристики снижаются незначительно, но повышается пластичность, а главное, снимаются зональные остаточные напряжения деформации, которые могут быть причиной коробления, снижения химической устойчивости и коррозионного растрескивания. Необходимые сочетания характеристик прочности и пластичности можно получить выбором степени деформации или температуры отжига; суммарная величина характеристик (при любой заданной) больше при выборе режима отжига.
При нагревании в атмосфере, содержащей кислород, сплавы серебра, золота, платины и палладия с медью (3–5 % и более) окисляются. Окисляются в некотором интервале температур сплавы, содержащие в значительных количествах палладий и родий. Окисления не происходит, если нагреть до температур, при которых окислы палладия и родия диссоциируют, а затем закаливать.
Ряд сплавов представляют собой однофазные твердые растворы только в некотором интервале высоких температур. При медленном охлаждении эти сплавы подвергаются превращениям: образование фаз Н. С. Курнакова, распад твердого раствора по перитектическим и эвтектическим реакциям и вследствие уменьшения растворимости при падении температуры и т. д. Образование фаз Н. С. Курнакова, имеющих обычно более низкие технологические показатели, чем исходные твердые растворы, происходит в сплавах золота с медью, золота с медью и серебром (часовые корпуса, ювелирные, художественные и другие изделия), платины с иридием (контакты и др.), платины с железом и кобальтом (постоянные магниты, постоянные электросопротивления и др.). В этом случае для повышения пластичности и уменьшения сопротивления деформации рекристаллизацию ведут в температурном интервале устойчивого существования твердого раствора (не менее чем на 30–50 °С выше точки превращения), а затем проводят закалку. В некоторых случаях закалка и последующий отпуск являются заключительной операцией технологического процесса (сплавы для постоянных магнитов, тензометров и потенциометров, пружинящих контактов, фильер для искусственного волокна, тонкостенных часовых корпусов и др.).
Большой интерес представляет изменение физико-механических свойств при термической обработке, связанной с переходом твердого раствора в фазу Курнакова. С явлением упорядочения, впервые открытым Н. С. Курнаковым, связан ферромагнитизм сплавов Pt–Cr, Pt–Co, Pt–Fe и др.
При отпуске сплавов AuCu3, Cu3Pd диамагнитная восприимчивость возрастает, а сплава AuCu уменьшается, электрическое сопротивление тоже падает. Модуль упругости с упорядочением возрастает в сплавах AuCu3 и Cu3Pd и уменьшается в сплавах AuCu и CuPd.
8. Сплавы с особыми свойствами
В современной технике (в производстве точных измерительных и регулирующих приборов и других средств автоматизации, химической и других отраслях промышленности) в ряде случаев требуется применение металлов и сплавов с особыми физико-химическими и механическими свойствами. К числу особых свойств относятся:
- отсутствие износа (опоры измерительных приборов);
- постоянство электросопротивления (потенциометры);
- сильное и постоянное изменение электросопротивления в зависимости от температуры (термометры сопротивления);
- сильное и постоянное изменение электродвижущей силы в зависимости от температуры (термопары);
- высокая коэрцитивная сила и остаточная индукция (постоянные магниты);
- низкая эрозия в сочетании с комплексом других свойств (электрические контакты);
- способность служить катализаторами химических реакций.
Катализаторы из платины и палладия применяют в компактном, губчатом и коллоидном состояниях, в виде черни, а также проволоки, фольги и сетки. Катализаторы из сплавов платины с родием (Pt + 7,0 % Rh) и платины с родием и палладием (Pt + 3,0 % Rh + 4,0 % Pd) изготавливают в виде сетки.
Опоры осей приборов — это иглы, опоры игл компасов и других вращающихся частей точных измерительных и регулирующих приборов практически не должны изнашиваться при заданных условиях работы. Поэтому необходимо, чтобы материал сочетал особо высокие показатели твердости, сопротивления истиранию и сопротивления коррозии.
Обычно применяют природный осмистый иридий в виде зерен диаметром 0,8–1,0 мм. Плавленые наконечники для приборов, а также «вечных перьев» изготавливают из сплавов Os–W–Co, Os–W–Ni, Ru–W–Ni и Ru–W–Co. Природные зерна и плавленые шарики припаивают серебряным или золотым припоем или приваривают (на конденсаторных сварочных аппаратах) к основе опор приборов или к перьям самописцев, авторучек и т. п.
Термометры сопротивления. Наиболее точно температуру измеряют с помощью платинового термометра сопротивления. Для этого используют платину особо высокой чистоты — для термометров первого класса допускается отклонение ± 0,05 % и второго класса ± 0,1 %.
Электрические постоянные сопротивления. Сплавы на основе благородных металлов (в сравнении с манганином, константаном и др.) используют в потенциометрах и других подобных элементах электрических приборов, т. к. они должны обладать постоянством электросопротивления в условиях эксплуатации. Сплавы применяют в виде пружин, спиралей тонкой и тончайшей проволоки, поэтому они должны сочетать высокую пластичность при холодной деформации с заданными физико-механическими свойствами после термической обработки (отпуска).
Термопары. Температуры в широком интервале (от 0 до 2000 °С) измеряют со значительной точностью в лабораторных и производственных условиях с помощью термоэлектрического пирометра. Наиболее высококачественные термопары по жаростойкости, стойкости к окислению, взаимодействию с окружающей средой, стабильности и плавности изменения ТЭДС изготавливают из платины и сплавов на основе платины с родием и иридием. Величина показаний, их точность и стабильность сильно зависят от чистоты металла и сплава. Для обеспечения высокой точности и надежности показаний каждую термопару необходимо градуировать в паре с гальванометрами.
Термопары с платиной с сплавами платины и родия наиболее устойчивы в защитной армировке из окиси алюминия. Недопустимо использование их в условиях, где возможен контакт с твердым углеродом, кремнием и кренеземом, фосфором и его соединениями.
Электрические контакты ответственного назначения, если требуется надежность и долговечность, отсутствие окисления и потускнения, малая испаряемость и высокая термическая стойкость, изготовляют обычно из благородных металлов (серебра, золота, платины и палладия) и их сплавов.
Серебро в чистом виде и в сплавах широко применяют как контактный материал в электротехнике, радиоэлектронике и т. п. Серебро имеет максимальную среди металлов тепло- и электропроводность, высокую кислотоупорность и отличную деформируемость.
Недостатком серебра как контактного материала является незначительная твердость, низкая температура плавления и склонность к образованию непроводящих (в технике слабых токов) слоев сульфида серебра на поверхности в присутствии серы в окружающей среде. В некоторых случаях из-за низкой твердости и легкоплавкости серебряные контакты свариваются и при постоянном токе образуют пики и кратеры.
Для контактов наиболее целесообразно использовать плакированные или покрытые гальваническим путем (толщина слоя серебра 5–20 мкм) цветные металлы и сплавы (медь, латунь фосфористая, бериллиевая и др. бронзы). Твердость гальванопокрытий из драгоценных металлов приведена в табл. 9.
Таблица 9. Твердость по Бринеллю гальванопокрытий из драгоценных металлов
| Металл | Ag | Au | Rh | Pd | Pt |
| HB, МПа | 70–1000 | 500–700 | 5000–7000 | 2000–2500 | 4000–5000 |
Добавление меди к серебру повышает твердость, стойкость к износу, незначительно снижает электропроводность и уменьшает кислотоупорность. Наиболее высокие свойства имеет сплав с 3 % Cu (твердое серебро). Иногда применяют сплавы с 5, 10 и 25 % Cu.
Введение кадмия в серебро предотвращает образование световой дуги и повышает склонность к сварке, лучшие результаты дает окись кадмия. Добавка 0,1 % Ni к серебру измельчает зерно Ag, что снижает его склонность к сварке. Контакты с 10, 20, 30 и 40 % Ni изготавливают спеканием. Никель не растворяется в серебре, и поэтому тепло- и электропроводность остаются высокими. Подобные сплавы применяются для контактов, реле, регуляторов напряжения и переключателей максимального тока.
Серебро с углеродом выдерживает высокие токи короткого замыкания без сваривания, но имеют незначительную стойкость к обгоранию. Ее можно повысить введением вольфрама и никеля.
9. Припои
Для соединения частей деталей и узлов машин, инструмента, приборов и других изделий в ряде случаев применяют пайку. При пайке место соединения деталей (или целиком) нагревают и зазор между ними заполняют расплавленным металлом или сплавом с припоем с более низкой температурой плавления (на 50–60 °С).
При охлаждении частей деталей припой кристаллизуется и соединяет их в одно целое.
Рассмотрим состав и свойства припоев и особенности пайки, если применяют благородные металлы и сплавы. На производство припоев расходуется серебро, золото, платина и палладий.
Чистое серебро в качестве припоя применяют весьма ограниченно: при соединении сплавов железо-никель с керамикой (предварительно покрытой по месту соединения железом и кобальтом); для электролитического нанесения по детали радиолокационных волноводов; на медные, латунные, бронзовые детали при производстве электрических контактов и т. п. Серебро вводят в свинцовые и медно-фосфористые припои для повышения прочности паяных соединений (на основе свинца), улучшения растекаемости припоя, увеличения прочности и пластичности (на основе медно-фосфористых). Медно-фосфористые припои с добавлением серебра лучше обрабатывать давлением, их применение обеспечивает высокое качество пайки медных сплавов в защитной атмосфере (без флюса).
В современной технике и производстве ювелирных и художественных изделий широко применяют припои (сплавы с большим содержанием или на основе серебра). Они имеют высокие технологические и эксплуатационные свойства, хорошо растекаются и смачивают поверхность, обеспечивают высокую прочность при обычных, а также ударных, длительных переменных нагрузках и вибрации, имеют высокое сопротивление коррозии.
Все серебряные припои по составу можно разделить на три основные группы: двойные (Ag–Cu), тройные (Ag–Cu–Zn) и многокомпонентные.
Двухкомпонентные припои серебра, содержащие 50–72 % Ag, имеют низкое удельное электросопротивление, не содержат испаряющихся при нагреве элементов и могут быть применены для пайки вакуумной аппаратуры. Они пригодны для пайки без флюса и защитной атмосферы.
Трехкомпонентные припои серебро-медь-цинк в широком диапазоне по составу имеют высокую жидкотекучесть и хорошо смачивают соединяемые поверхности. Припои обладают достаточно высокой обрабатываемостью в холодном состоянии, и из них можно получить ленту и проволоку. Часть тройных припоев можно подвергать горячей прокатке и прессованию.
Многокомпонентные припои на основе тройных содержат кадмий, никель и марганец и вытесняют трехкомпонентные. Введение кадмия в припои снижает температуру плавления, увеличивает жидкотекучесть, обеспечивая прочное и пластичное соединение. Температурные интервалы кристаллизации припоев различных систем показаны на рис. 26.
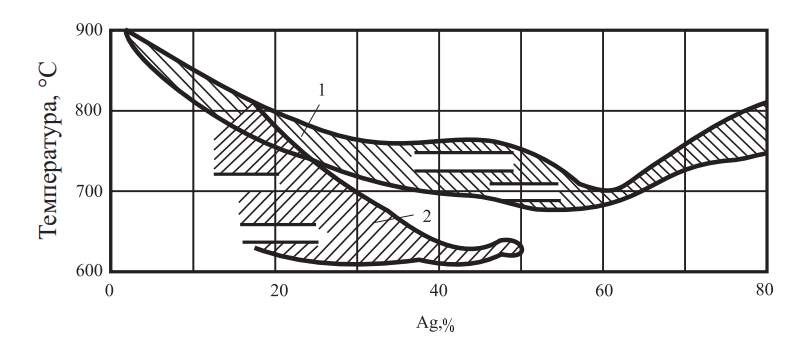
Рис. 26. Температурная область кристаллизации припоев: 1 — Ag–Cu–Zn; 2 — Ag–Cu–Zn–Cd
Наилучшие характеристики из системы Ag–Cu–Zn–Cd свойственны припоям с 40–50 % Ag.
Некоторые серебряные припои, кроме Cu, Zn и Cd, содержат и другие элементы — Mn, Ni, Si. Олово по своему действию в серебряных припоях подобно кадмию и цинку, но их можно использовать для пайки вакуумных приборов. Никель увеличивает смачиваемость и ускоряет затекание припоя в зазор, но вводить его надо обязательно при наличии меди в припое.
К числу особых требований к припоям относится жаропрочность. Так, например, крепление пайкой твердосплавного инструмента должно обеспечивать прочность до 400–450 °С, а деталей реактивной техники до 900–1000 °С. В качестве жаропрочных припоев применяют сплавы серебра с марганцем и в особо ответственных случаях припои на основе золота, палладия и платины. Жаропрочными припоями могут служить сплавы системы Au–Ca–Ni, где компонентами припоев служат обычно серебро, олово, никель, медь, а также индий (tпл = 180 °С).
Изделия из благородных металлов, в том числе часовые корпуса, ювелирные и другие художественные изделия, паяют исключительно припоями на основе соответствующих благородных металлов. Части изделий из серебра и его сплавов соединяют серебряными припоями, а из золота и его сплавов — золотыми.
К припоям, применяемым в ювелирном деле, наряду с обычными требованиями (прочность и пластичность соединения, коррозионная устойчивость, растекаемость и т. п.) предъявляются специфические требования:
- припой по цвету не должен заметно отличаться от цвета соединяемых деталей (особенно при наружной сварке);
- содержание соответствующего драгоценного металла в припое должно соответствовать (или быть близким) содержанию этого металла (пробности) в изделии.
Припои содержат обычно золото, серебро и медь (так же как и изделия), к которым для получения необходимых свойств добавляют цинк, кадмий и олово. Цвет сплава регулируют относительным содержанием серебра. Введение цинка и олова меньше осветляют сплав, чем кадмий. Кадмий вводят до 13 %, олова до 3 %. Наилучший результат получается при применении припоя системы Au–Ag–Cu–Zn–Sn.
