Содержание страницы
Металлы и сплавы играют ключевую роль в развитии технологий и инженерной мысли, находясь в основе большинства современных конструкций — от мостов и зданий до космических аппаратов. Однако даже самые прочные металлы подвержены разрушительному процессу — коррозии.
Коррозия снижает прочностные характеристики материалов, уменьшает срок службы изделий, приводит к экономическим потерям и, в некоторых случаях, даже к техногенным катастрофам. Именно поэтому проблема защиты металлов от коррозии остаётся одной из важнейших в технической науке и производственной практике.
Современный подход к обеспечению долговечности металлических конструкций требует системного понимания природы коррозионных процессов, а также глубоких знаний в области материаловедения, электрохимии и инженерии защитных покрытий.
Первые упоминания о разрушении металлов под воздействием внешней среды восходят к античным временам. Уже тогда мастера, работающие с бронзой и железом, замечали изменение цвета и прочности металлов при длительном контакте с влагой и воздухом. Однако научное изучение коррозии началось только в XVIII-XIX веках.
В 1830-х годах английский учёный Майкл Фарадей внёс огромный вклад в понимание электрохимических процессов, лежащих в основе коррозии. Его эксперименты с гальваническими элементами стали основой будущей теории электрохимической коррозии.
В XX веке, особенно после Второй мировой войны, проблема защиты от коррозии приобрела массовое значение в связи с ростом промышленности, строительством инфраструктуры и развитием транспортных систем. Были разработаны различные методы пассивации, гальванизации, катодной и анодной защиты, что значительно продвинуло отрасль вперёд.
1. Что такое коррозия металлов
Коррозия металлов представляет собой процесс разрушения металлических изделий и конструкций, происходящий самопроизвольно в результате взаимодействия с окружающей средой. Это разрушение может носить как химический, так и электрохимический характер, в зависимости от условий и природы среды.
Процессы коррозии развиваются на границе соприкосновения двух различных фаз – металла и среды, в которой он находится. Таким образом, коррозия всегда является гетерогенным явлением.

Ущерб от коррозии значителен и затрагивает практически все сферы производства и хозяйства. Принято делить эти потери на две основные категории: прямые и косвенные.
Прямые потери чаще всего связаны с утратой самого материала вследствие его коррозионного разрушения — будь то трубы, корпуса машин или другие металлические элементы.
Косвенные потери бывают ещё более масштабными. Они включают в себя издержки, возникающие при остановке технологического оборудования, нарушении производственного процесса, ремонте, замене элементов, утечках газа и нефти через проржавевшие трубопроводы и т.д.
В химии металлы классифицируются как восстановители, поскольку они с легкостью отдают свои валентные электроны и превращаются в положительные ионы. Их устойчивость к коррозии определяется в том числе значением стандартного электродного потенциала – параметра, который отражает способность металла к отдаче электронов. Существуют металлы с переменными степенями окисления – например, железо, хром или марганец.
На основе стандартных потенциалов можно выделить три категории металлов по активности:
- активные – от Li до Al включительно – способны вытеснять водород как из воды, так и из кислотных растворов;
- средней активности – от Mn до Pb включительно – вытесняют водород только из кислотных растворов;
- неактивные – все элементы, находящиеся в ряду после водорода, не взаимодействуют с кислотами с выделением водорода.
Следовательно, все металлы могут подвергаться самопроизвольному окислению. Это обусловлено их термодинамической нестабильностью, особенно в атмосфере или иной агрессивной среде. Уровень такой нестабильности напрямую зависит от природы самого металла, свойств среды и конкретных условий эксплуатации.
Основной причиной коррозии является взаимодействие металлов с компонентами среды, происходящее через химические или электрохимические реакции. Это приводит к постепенному разрушению их структуры.
По механизму протекания коррозионные процессы делятся на два фундаментальных типа:
- Химическая коррозия – это процессы, происходящие при непосредственном химическом взаимодействии металла с окружающей средой, при этом ток в системе не возникает.
- Электрохимическая коррозия – имеет место при контакте металла с водным раствором электролита. В процессе происходит перераспределение электронов и ионов, формируя электрический ток внутри системы.
Ниже приведена таблица 1, демонстрирующая стандартные электродные потенциалы различных металлов:
| Электрод | Ео, В | |||
| Окисленная форма | Восстановленная форма | |||
|
↑ Усиление окислительной способности (Мn+) |
Li+ | Li |
Усиление восстановительной способности (Мо) ↓ |
–3,04 |
| K+ | K | –2,92 | ||
| Ca2+ | Ca | –2,87 | ||
| Na+ | Na | –2,71 | ||
| Mg2+ | Mg | –2,37 | ||
| Al3+ | Al | –1,66 | ||
| Mn2+ | Mn | –1,18 | ||
| Zn2+ | Zn | –0,76 | ||
| Cr3+ | Cr | –0,74 | ||
| Fe2+ | Fe | –0,44 | ||
| Ni2+ | Ni | –0,25 | ||
| Sn2+ | Sn | –0,14 | ||
| Pb2+ | Pb | –0,13 | ||
| H+ | 1/2H2 | 0,00 | ||
| Cu2+ | Cu | +0,34 | ||
| Ag+ | Ag | +0,80 | ||
| Pt2+ | Pt | +1,20 | ||
| Au3+ | Au | +1,50 | ||
Существует множество типов коррозии, классифицируемых по разным признакам. По условиям возникновения можно выделить:
- газовую – при высокотемпературном воздействии газов;
- атмосферную – при контакте с воздухом и влажной средой;
- жидкостную – в жидких средах, включая растворы электролитов и неэлектролитов;
- подземную – в почвенной среде, характерна для подземных коммуникаций;
- биокоррозию – вызванную жизнедеятельностью микроорганизмов;
- структурную – возникающую в силу неоднородной микроструктуры сплавов;
- коррозию от блуждающих токов – особенно актуально для трубопроводов и железных конструкций;
- контактную – возникающую при взаимодействии разнородных металлов;
- щелевую – в труднодоступных полостях и зазорах;
- под напряжением – при наличии одновременно механических напряжений и агрессивной среды;
- кавитационную – совмещающую коррозию с механическим разрушением от микровзрывов пузырьков жидкости.
В зависимости от характера разрушения различают:
- сплошную или общую коррозию – охватывает всю поверхность, на которую воздействует среда; делится на равномерную, неравномерную и избирательную;
- местную – поражает отдельные участки; может проявляться в виде точечной (питтинг), сквозной, язвенной коррозии и других форм.
2. Методы защиты металлов от коррозии
С целью предотвращения разрушения металлов под действием внешних агрессивных факторов применяют разнообразные способы защиты. Эти методы включают изменение состава самого металла, модификацию среды, в которой находится конструкция, создание защитного электрического потенциала, а также нанесение покрытий, способных изолировать поверхность металла от контакта с коррозионной средой.
Легирование металлов представляет собой один из наиболее действенных способов повышения коррозионной устойчивости. Путем добавления в состав металла различных легирующих элементов можно существенно изменить его химические свойства. Так, легирование меди алюминием способствует значительному повышению её сопротивляемости к атмосферным воздействиям. В свою очередь, сталь становится более инертной к коррозионным процессам при добавлении никеля и хрома — такие сплавы применяются, например, в производстве нержавеющих сталей.
Электрохимическая защита конструкций от коррозии подразделяется на два основных типа: катодную и анодную. В рамках катодной защиты также различают внешнюю поляризацию и протекторный метод. При использовании внешнего тока защищаемый элемент подсоединяется к отрицательному полюсу источника постоянного тока. Положительный полюс подключается к вспомогательному электроду — это может быть, например, металлический лом, отрезки рельс или трубы.
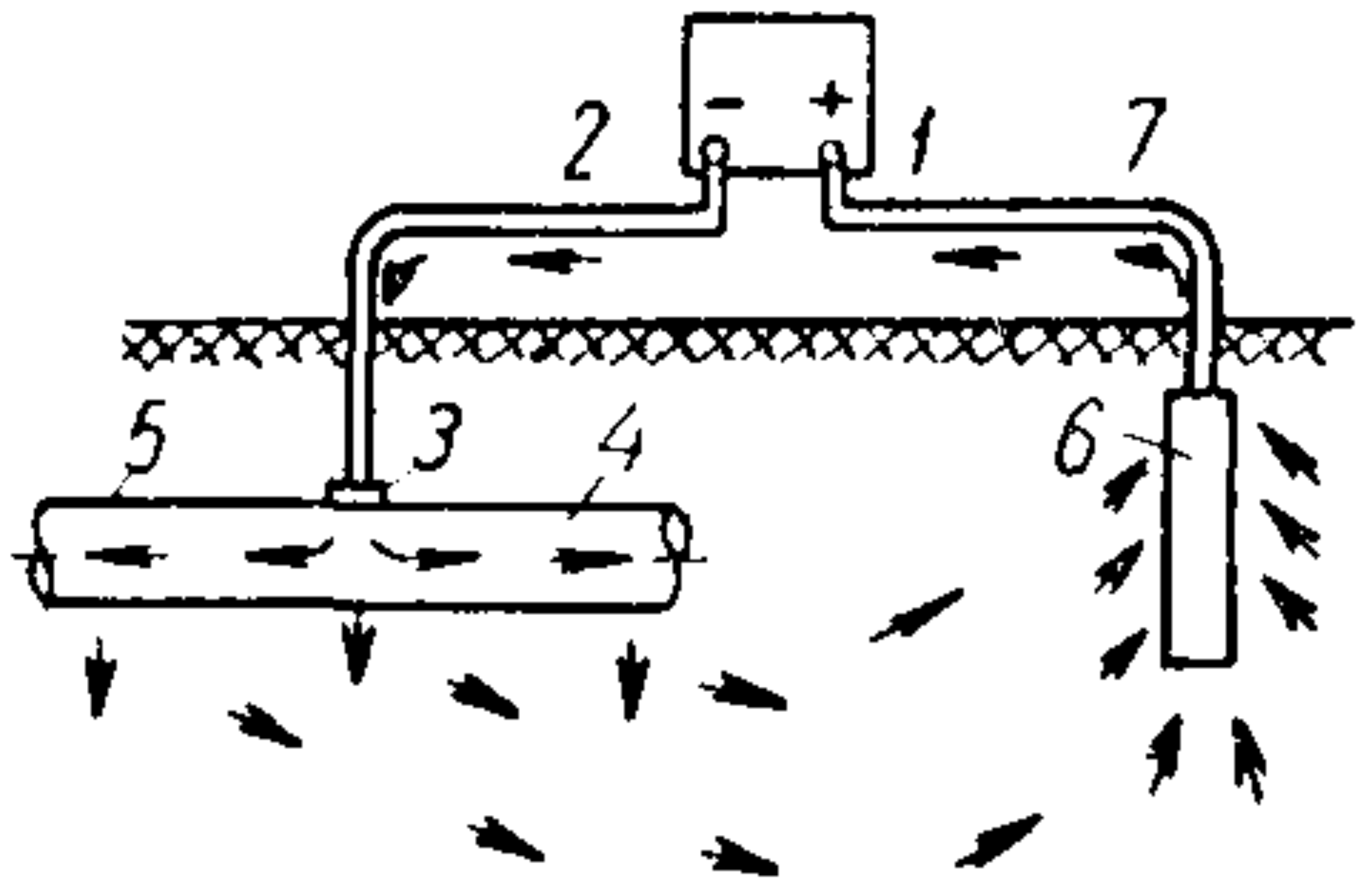
Рис. 1. Схема катодной защиты внешним током: 1 – источник постоянного тока; 2 – соединительный провод; 3 – пункт дренажа; 4 – защищаемая труба; 5 – изолирующее покрытие; 6 – анодное заземление; 7 – соединительный провод
Протекторная защита, показанная на рис. 2, работает на ином принципе. Она основывается на том, что к металлической конструкции подключается элемент, обладающий более низким (электроотрицательным) электродным потенциалом. Таким образом, протектор «жертвует собой», корродируя вместо основной конструкции. Чаще всего в этой роли используются цинковые или магниевые сплавы, а также композиции на основе алюминия. Данный способ находит применение в морской инженерии, в условиях влажных почв и при защите трубопроводов, заложенных под землю.
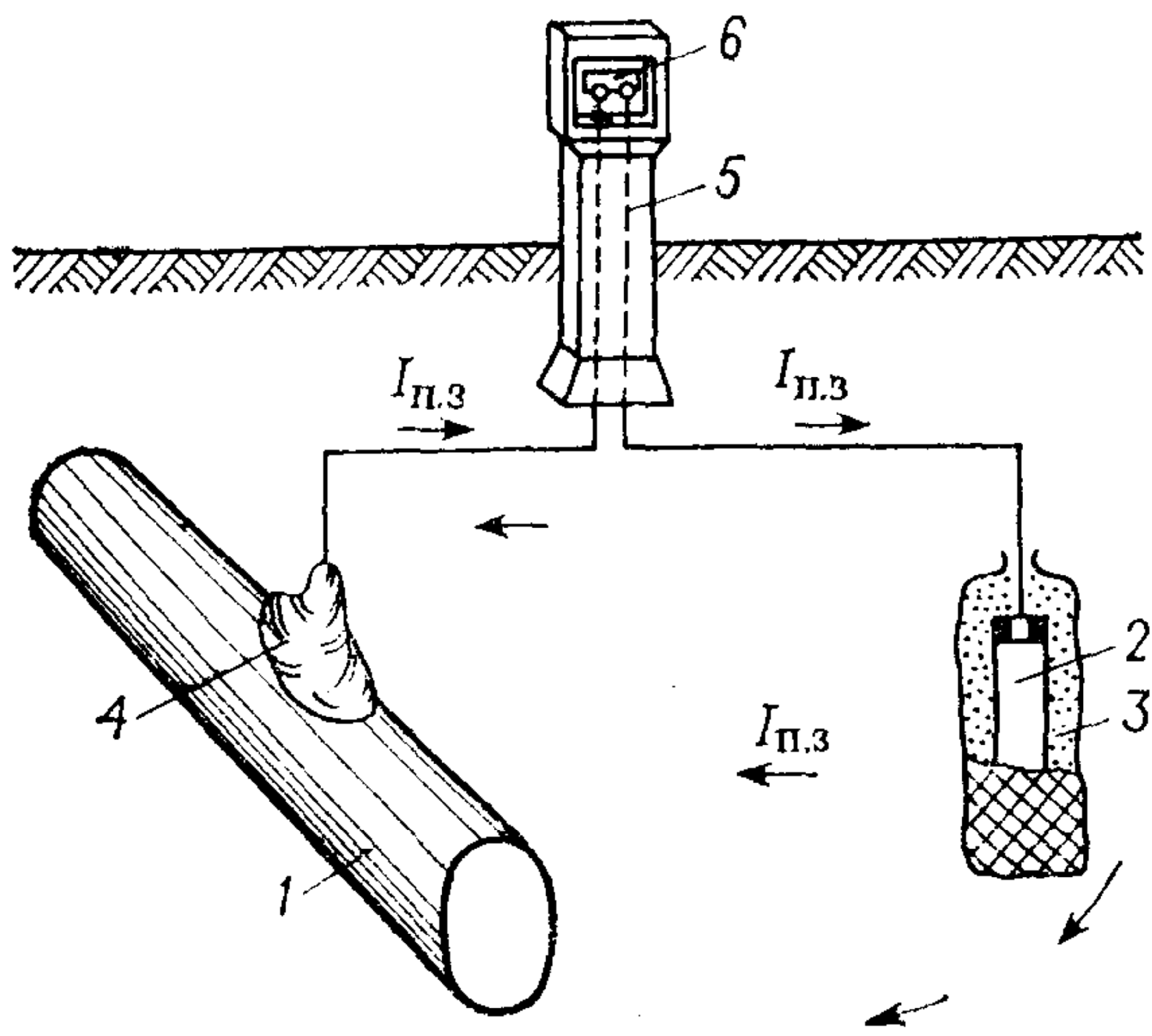
Рис. 2. Схема протекторной защиты: 1 – подземная стальная конструкция; 2 – протектор–магниевый сплав; 3 – заполнитель; 4 – электрический контакт; 5 – контрольно-измерительный вывод; 6 – закороченные клеммы; Iп.з – сила тока протекторной защиты
Модификация среды — еще один путь борьбы с коррозией. Ввод в систему ингибиторов позволяет существенно замедлить или даже полностью прекратить разрушение металлов. Эти вещества действуют как пассиваторы, образуя на поверхности металла защитные плёнки. Ингибиторы классифицируются по типу среды: существуют вещества, эффективные в кислых, щелочных или нейтральных растворах, а также в органических неводных жидкостях. Наибольшее распространение получили органические соединения, способные создавать на поверхности адсорбционные барьеры.
При этом эффективное использование ингибиторов возможно лишь в условиях, где объем рабочей среды относительно небольшой. Это делает метод особенно подходящим для лабораторных установок или оборудования с замкнутым циклом циркуляции жидкости.
Защитные покрытия — последний, но не менее важный барьер на пути коррозии. Существует множество видов покрытий: от металлических и лакокрасочных до полимерных и конверсивных, получаемых путем химической или электрохимической обработки поверхности. Основной задачей любого покрытия является изоляция металла от контакта с влагой, кислородом и другими компонентами агрессивной среды.
Выбор покрытия напрямую зависит от эксплуатационных условий. Например, для конструкций, которые не испытывают механической нагрузки и находятся внутри зданий (радиаторы, элементы интерьера), подойдёт однослойная окраска или химическое оксидирование. В то время как крупные конструкции, находящиеся на открытом воздухе и подверженные атмосферным осадкам (мосты, строительные краны, подвижной состав), требуют многослойных лакокрасочных систем, обеспечивающих не только барьерные, но и антикоррозионные свойства.
Таким образом, защита металлов от коррозии — это комплексный подход, включающий как внутренние (легирование), так и внешние меры (покрытия, ингибиторы, электрохимическая защита), обеспечивающий продление срока службы изделий и сооружений в самых различных условиях эксплуатации.
3. Коррозионностойкие металлы и сплавы
Коррозионностойкими металлами и сплавами называют конструкционные материалы, которые способны эффективно функционировать в агрессивных средах без необходимости применения дополнительных антикоррозионных мер. Их отличительной особенностью является не только способность сохранять массу, но и обеспечивать устойчивость и надежность конструкций при выполнении эксплуатационных нагрузок.
Формирование коррозионной стойкости может происходить благодаря разным факторам: это и способность металла пассивироваться, и образование плотных, слабо растворимых оксидных пленок, и даже чистота структуры сплава — поскольку наличие электроположительных примесей способствует возникновению коррозионных микрогальванических пар.
Некоторые металлы, такие как железо, хром, никель, алюминий и титан, характеризуются устойчивостью в результате образования пассивной пленки на поверхности. Однако даже эта устойчивость может быть нарушена в присутствии агрессивных ионов — например, хлора, фтора или брома. В то же время, наличие в среде окислителей может, наоборот, укреплять пассивное состояние.
Коррозионная активность металлов может быть предварительно оценена по значению стандартных электродных потенциалов. Чем более отрицателен электродный потенциал, тем выше химическая активность металла (табл. 2).
| Электродный потенциал, В | Характеристика термодинамической устойчивости металлов | Вероятные коррозионные процессы |
| Отрицательнее –0,414 | Низкая термодинамическая устойчивость – неблагородные металлы: Zn, Mn, Fe и др. | Подвержены коррозии в нейтральных средах без кислорода и окислителей |
| –0,414…0,0 | Металлы с недостаточной устойчивостью: Cd, Ni, Sn | Коррозия возможна при наличии кислорода и окислителей |
| 0,0…0,815 | Средняя устойчивость – полублагородные металлы: Cu, Bi, Ag | Сохраняют стойкость в нейтральных и кислых средах при отсутствии кислорода |
| Положительнее +0,815 | Высокая устойчивость – благородные металлы: Au, Pt, Pd | Устойчивы при наличии кислорода, окислителей и комплексообразователей |
Значения –0,414 В и +0,815 В соответствуют электродным потенциалам водородного и кислородного электродов в нейтральной среде и служат границами для оценки термодинамической устойчивости металлов.
Повышение коррозионной стойкости сплавов основано на воздействии на ключевые факторы, ограничивающие протекание электрохимической коррозии: анодное, катодное и омическое торможение. Эта концепция легла в основу трёх практических подходов к разработке устойчивых материалов:
- Формирование на поверхности металла плотной защитной пленки, образованной продуктами коррозии. Такой слой препятствует проникновению агрессивных веществ и замедляет реакции на катоде и аноде. Например, медь, введенная в железо, способствует его пассивации. Однако экранирование поверхности эффективно не всегда, особенно при интенсивной электрохимической коррозии.
- Снижение катодной активности металла. Это достигается уменьшением числа микрокатодов либо увеличением перенапряжения выделения водорода. Добавки сурьмы, висмута или мышьяка в железо заметно увеличивают его устойчивость к кислотной коррозии.
- Уменьшение анодной активности — наиболее надёжный путь в условиях, где возможно формирование пассивного слоя. Добавки хрома, никеля, палладия повышают термодинамическую стабильность анодной зоны. Например, хром существенно увеличивает стойкость стали в окисляющих кислотах.
Выбор метода повышения устойчивости зависит от условий воздействия. При наличии восстановительной среды (например, соляной кислоты) и отсутствии возможности пассивирования, важны меры по снижению активности анода и катода. В противоположных ситуациях, когда пассивация возможна, на первый план выходят методы, способствующие её стабилизации.
Если же пассивное состояние недостижимо (например, из-за хлоридов в растворе), то введение активных катодов может быть даже вредным. Именно поэтому выбор легирующих элементов требует точной оценки условий эксплуатации.
Для повышения стойкости в неокисляющих кислотах сплавы обогащаются медью и молибденом. Молибден способствует образованию пассивных слоев, устойчивых в агрессивной среде. Кислотостойкость меди объясняется её высокой стабильностью в условиях водородной деполяризации. Поверхность сплавов, легированных медью, в процессе коррозии постепенно обогащается этим металлом, создавая дополнительную защиту.
Если же рассматривать окисляющие среды, такие как азотная кислота, наиболее эффективны легирующие добавки, способствующие быстрой пассивации, в том числе хром. Так, хромистая сталь отличается высокой стойкостью в азотной кислоте. При этом в серной кислоте эффективны добавки палладия, особенно в аустенитной стали типа Х18Н10.
Таким образом, стратегии повышения устойчивости сплавов должны соответствовать конкретному типу среды: для нейтральных и окисляющих условий важна пассивация, для восстановительных — термодинамическая устойчивость или снижение активности катодов. Только индивидуальный подход к выбору состава сплава гарантирует его надёжную эксплуатацию в агрессивных условиях.
Интересные факты:
- По оценкам исследователей, ежегодные потери от коррозии в мировой экономике составляют около 2-3% ВВП отдельных стран — это сотни миллиардов долларов.
- Одним из самых коррозионно-стойких материалов является золото — оно практически не окисляется ни в одной природной среде. — В истории известен случай, когда мост, построенный из незащищённой стали, разрушился всего за 13 лет эксплуатации из-за агрессивного воздействия морской воды.
- Термин «пассивное состояние» впервые ввёл в научный оборот немецкий химик Кристиан Вильгельм Блуменбах ещё в XIX веке.
- Современные сверхкоррозионностойкие сплавы могут использоваться в условиях агрессивных сред, таких как внутренние камеры реакторов, химические хранилища или даже в составе космических зондов, работающих в атмосфере Венеры.
Коррозия — это не просто химическое разрушение металла, это сложный процесс, влияющий на безопасность, экономику и долговечность инженерных сооружений. Защита от коррозии требует как научного подхода, так и практического опыта. Использование современных сплавов, инновационных покрытий и методов электрохимической защиты позволяет эффективно противостоять разрушительному воздействию среды.
Понимание природы коррозии и использование соответствующих методов профилактики позволяют значительно увеличить срок службы металлических конструкций, снизить эксплуатационные расходы и предотвратить опасные аварии. В условиях современных технологических вызовов борьба с коррозией становится неотъемлемой частью устойчивого развития и надёжной инженерной практики.
