Содержание страницы
1. Состав природных газов
Физико-химические и теплотехнические характеристики природных газов обусловлены различием в составе горючих компонентов и наличием в газе негорючих газообразных компонентов (балластов) и вредных примесей.
К горючим компонентам относят следующие вещества.
Метан СН4. Содержание метана в природных газах достигает 98 %, и его свойства практически полностью определяют свойства природных газов.
В состав метана входит 75 % углерода и 25 % водорода; 1 м3 метана имеет массу 0,717 кг. При атмосферном давлении и температуре 111 К метан сжижается и его объем уменьшается в 600 раз. Использование и транспортирование сжиженного газа дает большой экономический эффект, позволяет значительно снизить затраты на сооружение газопроводов и помогает решить проблемы, связанные с резервированием газоснабжения в отдельных районах и созданием запасов сырья для промышленности.
Вследствие содержания в метане 25 % водорода (по массе) имеется большое различие между высшей и низшей теплотой сгорания.
Высшая теплота сгорания метана QB составляет 39820 кДж/м3, 9510 ккал/м3; низшая QH – соответственно 35880 кДж/м3, 8570 ккал/м3.
Метан обладает сравнительно низкой реакционной способностью, так как на разрыв четырех связей в молекуле метана требуются большие затраты энергии. Кроме метана в горючих газах могут содержаться этан С2Н6, пропан С3Н8, бутан C4H10. Углеводороды метанового ряда имеют общую формулу СnН2n+2, где n – углеродное число, равное 1 (для метана), 2 (для этана) и 3 (для пропана). Структура молекул этих углеводородов может быть представлена в следующем виде (рис. 1):
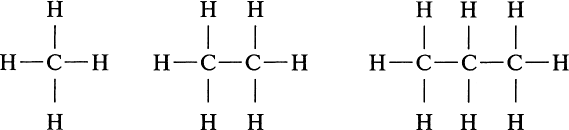
Рис. 1. Структура молекул углеводородов
С увеличением числа атомов в молекуле тяжелых углеводородов возрастают их плотность и теплота сгорания.
Оксид углерода СО – бесцветный газ без запаха и вкуса; масса 1 м3 составляет 1,25 кг; теплота сгорания 13250 кДж/м3, 3016 ккал/м3. В газах, содержащих метан и другие углеводороды, увеличение процентного содержания оксида углерода понижает теплоту сгорания газа. Оксид углерода оказывает на организм человека токсическое воздействие, так как легко вступает в соединение с гемоглобином крови. В табл. 1 показано влияние оксида углерода на организм человека при различных его концентрациях в воздухе.
Водород Н2 – бесцветный нетоксичный газ без вкуса и запаха, масса 1 м3 равна 0,09 кг. Он в 14,5 раза легче воздуха, отличается высокой реакционной способностью; водородно-воздушные смеси имеют широкие пределы воспламенения и весьма взрывоопасны.
Таблица 1. Физиологическое воздействие оксида углерода СО на организм человека
| Содержание СО в воздухе | Длительность и характер воздействия | |
| объем, % | мг/л | |
| 0,01 | 0,125 | В течение нескольких часов не оказывает воздействия |
| 0,05 | 0,625 | В течение 1 ч нет заметного воздействия |
| 0,1 | 1,25 | Через 1 ч наблюдаются головная боль, тошнота, недомогание |
| 0,5 | 6,25 | Через 20–30 мин оказывает смертельное воздействие |
Теплота сгорания водорода составляет: QB – 12750 кДж/м3, 3040 ккал/м3; QH – соответственно 10790 кДж/м3, 2580 ккал/м3. Сгорая в теоретически необходимом количестве воздуха, 1 м3 водорода образует 2,88 м3 продуктов горения.
В негорючую часть газообразного топлива входят азот и диоксид углерода.
Азот N2 – двухатомный бесцветный газ без запаха и вкуса, масса 1 м3 азота равна 1,25 кг. Атомы азота соединены между собой в молекуле тройной связью, на разрыв этой связи расходуется 170200 ккал/моль. Азот практически не реагирует с кислородом, поэтому при расчетах процесса горения его рассматривают как инертный газ.
Диоксид углерода СО2 – бесцветный газ, тяжелый и слабореакционный при низких температурах, имеет слегка кисловатый запах и вкус. Концентрация СО2 в воздухе в пределах 4–5 % приводит к сильному раздражению органов дыхания; 10 %-ная концентрация СО2 в воздухе вызывает сильное отравление. Масса 1 м3 СО2 составляет 1,98 кг. Диоксид углерода тяжелее воздуха в 1,53 раза, при температуре –20 °С и давлении 5,8 МПа превращается в жидкость, которую можно перевозить в стальных баллонах.
В горючих газах могут содержаться также сероводород и кислород.
Сероводород H2S – тяжелый газ с сильным и неприятным запахом, напоминающим запах тухлых яиц, обладает высокой токсичностью. Масса 1 м3 сероводорода равна 1,54 кг; является газообразной кислотой и, воздействуя на металлы, образует сульфиды. Поэтому он сильно корродирует газопроводы, особенно при одновременном содержании в нем H2S, H2O и О2. При сжигании газа сероводород образует сернистый газ, вредный для здоровья. Содержание сероводорода не должно превышать 2 г на 100 м3 газа.
Кислород О2 – газ без запаха, цвета и вкуса, масса 1 м3 кислорода составляет 1,43 кг. Содержание кислорода в газе понижает его теплотворную способность и делает газ взрывоопасным. Поэтому содержание кислорода в газе не должно быть более 1 % по объему.
Все природные газы в большинстве своем не имеют запаха. Чтобы утечки газа были своевременно обнаружены, горючие газы одоризируют, то есть придают им специфический запах, по которому их легко обнаружить даже при незначительных концентрациях в воздухе помещений. Наиболее часто в качестве одоранта применяют этилмеркоптан.
2. Единицы измерения параметров газа
Измерение давления газа. Величину избыточного давления газа измеряют манометрами, а для получения абсолютного давления необходимо к избыточному давлению прибавить атмосферное давление.
В системе СИ единица измерения давления – паскаль (Па), которая обозначает давление, вызываемое силой 1 ньютон (Н), равномерно распределенной по нормальной к ней поверхности площадью 1 м2. Соотношения между единицами измерения давления приведены в табл. 2.
Таблица 2. Соотношение между единицами давления газа
| Обозначение единиц | Па | дин/ cм2 | кгс/м2 | кгс/cм2 (ат) | бар | мм вод. ст. | мм рт. ст. |
| 1 паскаль (Па) | 1 | 10 | 0,102 | 102·10–6 | 10–5 | 0,102 | 7,5·10–3 |
| 1 дин/cм2 | 0,1 | 1 | 10,2·10–3 | 1,02·10–6 | 10–6 | 10,2·10–3 | 750·10–6 |
| 1 кгс/м2 | 9,81 | 98,1 | 1 | 10–4 | 98,1·
10–6 |
1 | 73,56·
10–3 |
| 1 кгс/cм2 (ат) | 98,1·103 | 98·103 | 104 | 1 | 0,981 | 104 | 735,6 |
| 1 бар | 105 | 106 | 10,2·103 | 1,02 | 1 | 10,2·103 | 750 |
| 1 мм вод. ст. | 9,81 | 98,1 | 1 | 10–4 | 98,1·
10–6 |
1 | 73,56·
10–3 |
| 1 мм рт. ст. | 133,3 | 1333 | 13,6 | 1,36·10–3 | 1,333·
10–3 |
13,6 | 1 |
Измерение температуры. При нагревании тела расширяются и увеличиваются в объеме. Больше всего расширяются газообразные тела, меньше – твердые. Например, газопровод длиной 100 м при нагревании до 100 °С увеличит свою длину только на 12 см; 100 л воды при нагревании до 100 °С увеличат свой объем на 4 л. При нагревании газа от 0 до 273 °С его объем увеличивается в два раза.
Температуру газа измеряют жидкостными термометрами, шкала которых имеет две постоянные точки: таяния льда (0 °С) и кипения воды (100 °С). Наиболее точны и просты в обращении ртутные термометры. Применяют также и шкалу Кельвина, в которой точка 0 соответствует абсолютному нулю, то есть такой степени охлаждения тела, при которой прекращается всякое движение молекул любого вещества. Абсолютный нуль, принимаемый за начало отсчета температур в системе СИ, в технической системе равен 273,16 °С. Таким образом, показания абсолютной шкалы больше на 273,2 °С.
Пример. Если продукты сгорания газа имеют температуру по Цельсию 200 °С, то по абсолютной шкале Кельвина та же температура равна 200 + 273,16 = 473,16 К.
Измерение количества теплоты. В качестве основной единицы измерения количества теплоты ранее принималась калория (кал) – это количество теплоты, которое необходимо сообщить 1 г дистиллированной воды для повышения ее температуры с 19,5 до 20,5 °С при давлении 101,325 кПа.
В теплотехнике применяется укрупненная единица измерения – килокалория (ккал), равная 1000 кал. Килокалория – это количество теплоты, которое необходимо сообщить 1 кг дистиллированной воды для повышения ее температуры на 1 °С.
В системе единиц СИ теплота выражается универсальной единицей – джоулем (Дж). Джоуль – это работа, которую совершает сила в 1 Н на пути в 1 м. Можно применить и более крупную и удобную единицу (килоджоуль, кДж), равную 1000 Дж, 1 Дж = 0,239 кал.
Количество теплоты, которое выделяется при полном сгорании 1 м3 газа, называется удельной теплотой сгорания газового топлива. Теплоту сгорания газа измеряют в ккал/м3 при температуре 20 °С и давлении 760 мм рт. ст. Различают низшую теплоту сгорания QН и высшую QB.
Высшую и низшую теплоту сгорания природного газа подсчитывают по следующим формулам:
QВ = 95СН4 + 167С2Н6 + 237С3Н8 + 307С4Н10
Qн = 85,5СН4 + 152С2Н6 + 218С3Н8 + 284С4Н10,
где СН4, С2Н6, С3Н8, С4Н10 – содержание в природном газе метана, этана, пропана и бутана в процентах по объему. Цифровые значения обозначают низшие и высшие теплоты сгорания метана, этана и т. д., пересчитанные на 1 % горючего компонента.
Перевод физических единиц количества теплоты в систему СИ приведен в табл. 3.
Таблица 3. Перевод количества теплоты, выраженной в калориях, на джоули
| Калории, кал | Калории, кал | |||||||||
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| Джоули, Дж | ||||||||||
| 0 | 0 | 4,2 | 8,4 | 12,6 | 16,7 | 20,9 | 25,1 | 29,3 | 33,5 | 37,7 |
| 10 | 41,9 | 46,1 | 50,2 | 54,4 | 58,6 | 62,8 | 67 | 71,2 | 75,4 | 79,5 |
| 20 | 83,7 | 87,9 | 92,1 | 96,3 | 100,5 | 104,7 | 108,9 | 113 | 117,2 | 121,4 |
| 30 | 125,6 | 129,8 | 134 | 138,1 | 142,4 | 146,6 | 150,7 | 154,9 | 159,1 | 163,3 |
| 40 | 167,5 | 171,7 | 175,8 | 180 | 184,2 | 188,4 | 192,6 | 196,8 | 201 | 205,9 |
| 50 | 209,3 | 213,5 | 217,7 | 221,9 | 226,1 | 230,3 | 234,5 | 238,7 | 242,8 | 247 |
| 60 | 251,2 | 255,4 | 259,6 | 263,3 | 268 | 272,1 | 276,3 | 280,5 | 284,7 | 288,9 |
| 70 | 293,1 | 297,3 | 301,4 | 305,6 | 308,9 | 314 | 318,2 | 322,4 | 326,6 | 330,8 |
| 80 | 334,9 | 339,1 | 343,3 | 347,5 | 351,7 | 355,9 | 360,1 | 364,3 | 368,4 | 372,6 |
| 90 | 376,8 | 361 | 385,3 | 389,4 | 393,6 | 397,7 | 401,9 | 406,1 | 410,3 | 414,5 |
Примечания:
|
||||||||||
Для удобства сравнения различных видов топлива введено понятие условного топлива, теплоту сгорания которого принимают равной 7000 ккал/кг, или 29288 кДж/кг.
Чтобы привести любое топливо к условному, необходимо значение его низшей теплоты сгорания разделить на эту величину. Величина, показывающая, во сколько раз теплота сгорания данного топлива больше теплоты сгорания условного топлива, называется тепловым эквивалентом.
Для метана тепловой эквивалент
Ккал = QH/7000 = 8558/7000 = 1,22,
где QH – низшая теплота сгорания метана, ккал/м3;
7000 – теплота сгорания условного топлива. 1 м3 метана эквивалентен 1,22 кг условного топлива.
Измерение объема и плотности газов. Объем газа измеряют в кубических метрах (м3). В связи с тем, что объем газов значительно изменяется при нагревании, охлаждении и сжатии, для сравнения объемных количеств газа их приводят к нормальным и стандартным условиям.
Нормальными условиями принято считать температуру 0 °С (273,2 К) и давление 101,325 кПа. На практике за единицу измерения количества газа принимают 1 м3 газа, взятого при давлении 101,325 кПа, температуре 20 °С и нулевой влажности. Эти условия принято считать стандартными. Для пересчета параметров, характеризующих состояние газа, на нормальные или стандартные условия можно использовать следующие формулы:
приведение газа к нормальным условиям
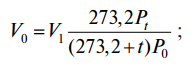 (1)
(1)
приведение газа к стандартным условиям
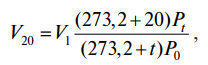 (2)
(2)
где V0 – объем газа при нормальных условиях;
Vt – объем газа при заданном давлении и температуре t, °С;
Pt – давление газа в момент измерения объема газа при температуре t, °С;
Р0 – нормальное давление газа (101,325 кПа); 273,2 – нормальная температура, К;
V20 – объем газа при стандартных условиях, то есть при t = 273,2 + 20 = 293,2 К и давлении Р0.
Масса газа в единице объема называется плотностью. Применительно к газам плотность имеет размерность кг/м3 и определяется обычно при температуре 0 °С и давлении 101,325 кПа.
Чтобы показать, насколько 1 м3 данного газа легче или тяжелее 1 м3 воздуха, определяют относительную плотность. Для этого необходимо плотность газа разделить на плотность воздуха при нормальных условиях.
3. Основные законы газового состояния
В основе физических свойств газов и законов газового состояния лежит молекулярно-кинетическая теория газов. Большинство законов газового состояния было выведено для идеального газа, молекулярные силы которого равны нулю, а объем самих молекул бесконечно мал по сравнению с объемом межмолекулярного пространства.
Молекулы реальных газов помимо энергии прямолинейного движения обладают энергией вращения и колебания. Они занимают некоторый объем, то есть имеют конечные размеры. Законы для реальных газов несколько отличаются от законов для идеальных газов. Это отклонение тем больше, чем выше давление газов и ниже их температура, оно учитывается введением в соответствующие уравнения поправочного коэффициента сжимаемости.
При транспортировании газов по трубопроводам под высоким давлением коэффициент сжимаемости имеет большое значение.
При давлениях газа в газовых сетях до 1 МПа законы газового состояния для идеального газа достаточно точно отражают свойства природного газа. При более высоких давлениях или низких температурах применяют уравнения, учитывающие объем, занимаемый молекулами, и силы взаимодействия между ними, или вводят в уравнения для идеального газа поправочные коэффициенты – коэффициенты сжимаемости газа.
Закон Бойля – Мариотта. Многочисленными опытами установлено, что если взять определенное количество газа и подвергать его различным давлениям, то объем этого газа будет изменяться обратно пропорционально величине давления. Эта зависимость между давлением и объемом газа при постоянной температуре выражается следующей формулой:
p1/p2 = V2/V1, или V2 = p1V1/p2, (3)
где р1, и V1 – первоначальные абсолютное давление и объем газа;
р2 и V2 – давление и объем газа после изменения.
Из формулы (3) можно получить следующее математическое выражение:
V2p2 = V1p1 = const. (4)
То есть произведение величины объема газа на величину соответствующего этому объему давления газа будет постоянной величиной при постоянной температуре. Этот закон имеет практическое применение в газовом хозяйстве. Он позволяет определять объем газа при изменении его давления и давление газа при изменении его объема при условии, что температура газа остается постоянной. Чем больше при постоянной температуре увеличивается объем газа, тем меньше становится его плотность.
Зависимость между объемом и плотностью выражается формулой:
V1/V2 = ρ2/p1, (5)
где V1 и V2 – объемы, занимаемые газом;
ρ1 и ρ2 – плотности газа, соответствующие этим объемам.
Если в уравнении (3) отношение объемов газа заменить отношением их плотностей, то на основании уравнения (5) можно получить:
ρ2/ρ1 = p2/p1, или ρ2 = p2ρ1/p1. (6)
Из уравнения (6) можно сделать вывод, что при одной и той же температуре плотности газов прямо пропорциональны давлениям, под которыми находятся эти газы, то есть плотность газа (при постоянной температуре) будет тем больше, чем больше его давление. Пример. Объем газа при давлении 760 мм рт. ст. и температуре 0 °С составляет 300 м3. Какой объем займет этот газ при давлении 1520 мм рт. ст. и при той же температуре?
760 мм рт. ст. = 101329 Па = 101,3 кПа; 1520 мм рт. ст. = 202658 Па = 202,6 кПа.
Подставляя заданные значения V, р1, р2 в формулу (3), получим, м3:
V2 = 101, 3·300/202,6 = 150.
Закон Гей-Люссака. При постоянном давлении с повышением температуры объем газов увеличивается, а при понижении температуры уменьшается, то есть при постоянном давлении объемы одного и того же количества газа прямо пропорциональны их абсолютным температурам. Математически эта зависимость между объемом и температурой газа при постоянном давлении записывается так:
V2/V1 = T2/T1, (7)
где V – объем газа;
Т – абсолютная температура.
Из формулы (7) следует, что если определенный объем газа нагревать при постоянном давлении, то он изменится во столько раз, во сколько раз изменится его абсолютная температура.
Установлено, что при нагревании газа на 1 °С при постоянном давлении его объем увеличивается на постоянную величину, равную 1/273,2 первоначального объема. Эта величина называется термическим коэффициентом расширения и обозначается β. С учетом этого закон Гей-Люссака можно сформулировать так: объем данной массы газа при постоянном давлении есть линейная функция температуры:
Vt, = V0 (l + βt) или Vt, = V0Т/273. (8)
Закон Шарля. При постоянном объеме абсолютное давление неизменного количества газа прямо пропорционально его абсолютным температурам. Закон Шарля выражается следующей формулой:
p2/p1 = Т2/Т1, или p2 = р1Т2/Т1, (9)
где р1 и р2 – абсолютные давления;
Т1 и Т2 – абсолютные температуры газа.
Из формулы (9) можно сделать вывод, что при постоянном объеме давление газа при нагревании увеличивается во столько раз, во сколько раз увеличивается его абсолютная температура.
