Содержание страницы
- 1. Компонентный состав и характеристики природных газов
- 2. Классификация природных газов
- 3. Единицы измерения ключевых параметров газа
- 4. Физические и термодинамические свойства природного газа
- 5. Фундаментальные законы газового состояния
- 6. Сравнительная характеристика различных видов газового топлива
- 7. Транспортировка и хранение
- 8. Технологические применения природного газа
- 9. Экология
- Интересные факты о природном газе
- Заключение
Природный газ — это сложная смесь углеводородных и неуглеводородных компонентов, чьи уникальные физико-химические и теплотехнические свойства определяют его ценность для энергетики и промышленности. Зародившись в недрах земли миллионы лет назад в результате анаэробного разложения органических веществ, сегодня он является одним из столпов мировой экономики. В данном материале мы проведем всесторонний анализ компонентного состава, свойств, а также рассмотрим фундаментальные газовые законы, управляющие его поведением.
Природный газ, известный человечеству на протяжении тысячелетий, изначально воспринимался как диковинка или священное явление. Древние цивилизации в Греции, Персии и Индии строили храмы вокруг вечных огней, которые представляли собой выходы газа на поверхность. Однако его промышленное использование началось значительно позже. Впервые газ был целенаправленно добыт и использован для освещения в городе Фредония, штат Нью-Йорк, в 1821 году. Настоящая революция в его применении произошла в XX веке с изобретением бесшовных труб, что сделало возможной его безопасную транспортировку на большие расстояния и превратило его в ключевой источник энергии для отопления, выработки электроэнергии и промышленности.

Географически природный газ распределен по планете неравномерно. Его крупнейшие месторождения, как правило, связаны с осадочными бассейнами, где в течение миллионов лет из органических остатков под высоким давлением и температурой формировались углеводороды. Основные запасы сосредоточены в нескольких ключевых регионах. Россия обладает самыми большими доказанными запасами, за ней следуют страны Ближнего Востока, такие как Иран и Катар. Значительные месторождения также находятся в Северной Америке (США и Канада) и Азиатско-Тихоокеанском регионе. Добыча и транспортировка газа, осуществляемая по газопроводам и в виде сжиженного природного газа (СПГ) на танкерах, формируют сложную глобальную энергетическую карту, оказывая существенное влияние на мировую экономику и геополитику.
1. Компонентный состав и характеристики природных газов
Основные эксплуатационные характеристики любого природного газа напрямую зависят от процентного соотношения его горючих компонентов, а также от наличия инертных (балластных) примесей и агрессивных химических соединений. Каждый компонент вносит свой вклад в итоговую теплотворную способность, плотность, токсичность и коррозионную активность топливной смеси. Компонентный состав определяется следующими нормативами: ГОСТ 31371.1-2020 (ISO 6974-1:2012) «Газ природный. Определение состава методом газовой хроматографии с оценкой неопределённости».
1.1. Горючая фракция
Основа любого горючего газа — это углеводороды, которые при сгорании выделяют значительное количество тепловой энергии.
Метан (СН4). Это альфа и омега природного газа. Его содержание в газах из чисто газовых месторождений может достигать 98-99%, что делает его свойства определяющими для всей смеси. Молекула метана состоит из одного атома углерода и четырех атомов водорода (75% углерода и 25% водорода по массе). Это простейший углеводород, обладающий высокой стабильностью из-за прочных ковалентных связей, на разрыв которых требуется значительная энергия. При стандартных условиях это газ без цвета и запаха, с массой 1 м³ равной 0,717 кг.
Одно из важнейших свойств метана — его способность к сжижению. При атмосферном давлении и глубоком охлаждении до температуры -161,5 °C (111,6 К) метан переходит в жидкое состояние, а его объем при этом сокращается примерно в 600 раз. Эта особенность лежит в основе технологии сжиженного природного газа (СПГ), которая произвела революцию в транспортировке и хранении газа. СПГ позволяет доставлять энергоресурсы на любые расстояния морским путем, создавать стратегические резервы и обеспечивать газом регионы, удаленные от магистральных газопроводов.
Из-за высокого содержания водорода в молекуле, существует значительная разница между высшей и низшей теплотой сгорания метана:
- Высшая теплота сгорания (QB) составляет 39820 кДж/м³ (приблизительно 9510 ккал/м³).
- Низшая теплота сгорания (QH) составляет 35880 кДж/м³ (приблизительно 8570 ккал/м³).
Помимо метана, в состав газа входят и его гомологи — более тяжелые углеводороды метанового ряда с общей формулой CnH2n+2:
- Этан (С2Н6)
- Пропан (С3Н8)
- Бутан (C4H10)
Эти компоненты обладают более высокой плотностью и теплотой сгорания по сравнению с метаном. Они являются ценнейшим сырьем для нефтехимической промышленности, служа основой для производства пластмасс, каучуков и других полимеров. Структурные формулы простейших углеводородов наглядно демонстрируют их строение (рис. 1).
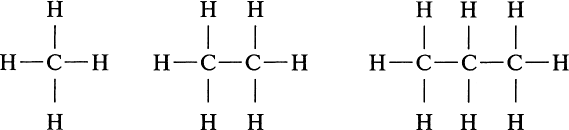
Рис. 1. Структура молекул углеводородов: а) метан, б) этан, в) пропан
Оксид углерода (СО), или угарный газ. Это бесцветный газ, не имеющий запаха и вкуса, что делает его особенно коварным. Его масса (1,25 кг/м³) близка к массе воздуха. Обладает сравнительно невысокой теплотой сгорания (13250 кДж/м³ или 3016 ккал/м³), поэтому его присутствие в природном газе снижает общую калорийность смеси. Главная опасность СО заключается в его чрезвычайной токсичности для человека и животных. Он активно связывается с гемоглобином в крови, образуя карбоксигемоглобин и блокируя перенос кислорода к тканям, что вызывает кислородное голодание (гипоксию). Его предельно допустимая концентрация (ПДК) в воздухе рабочей зоны строго нормируется.
Водород (Н2). Самый легкий из всех известных газов, без цвета, вкуса и запаха. Его масса составляет всего 0,09 кг/м³, он в 14,5 раз легче воздуха. Водород обладает высокой химической активностью и очень широкими пределами воспламенения в смеси с воздухом (от 4% до 75% по объему), что делает такие смеси крайне взрывоопасными. Теплота сгорания водорода: QB – 12750 кДж/м³ (3040 ккал/м³); QH – 10790 кДж/м³ (2580 ккал/м³). При его сгорании образуется только водяной пар, что делает его перспективным экологически чистым топливом будущего.
1.2. Негорючая (балластная) часть и вредные примеси
Эти компоненты не участвуют в процессе горения, снижают теплотворную способность газа и могут вызывать серьезные технические и экологические проблемы.
Азот (N2). Основной компонент атмосферного воздуха. Это инертный двухатомный газ без цвета и запаха, масса 1 м³ которого равна 1,25 кг. Молекула азота отличается чрезвычайной прочностью тройной связи между атомами, на разрыв которой требуется колоссальная энергия (около 945 кДж/моль). В условиях горения топлива азот практически не вступает в реакции и рассматривается как инертный разбавитель, который лишь уносит часть тепла с уходящими газами, снижая температуру горения и КПД установок.
Диоксид углерода (СО2), или углекислый газ. Бесцветный, негорючий газ с характерным кисловатым запахом и вкусом. Он значительно тяжелее воздуха (масса 1 м³ составляет 1,98 кг). Являясь балластом, СО2 снижает теплоту сгорания газа. В присутствии влаги он образует слабую угольную кислоту (H2CO3), которая может вызывать коррозию трубопроводов и оборудования. Высокие концентрации СО2 в воздухе опасны для дыхания: уже 4–5% вызывают недомогание, а 10% могут привести к быстрой потере сознания и смерти.
Сероводород (H2S). Это одна из самых опасных и нежелательных примесей. Тяжелый газ (масса 1 м³ – 1,54 кг) с узнаваемым резким запахом тухлых яиц, который ощущается даже при минимальных концентрациях. Сероводород чрезвычайно токсичен (сравним по действию с цианидами) и обладает высокой коррозионной активностью. В присутствии влаги он образует сернистую кислоту, которая агрессивно разрушает металл газопроводов и арматуры. При сжигании газа, содержащего H2S, образуется диоксид серы (SO2) — основной компонент кислотных дождей. Поэтому содержание сероводорода в газе, поставляемом потребителям, строго регламентируется ГОСТ 5542-2022 «Газы горючие природные промышленного и коммунально-бытового назначения. Технические условия» и не должно превышать 0,002 г/м³.
Кислород (О2). Газ без цвета, запаха и вкуса, масса 1 м³ — 1,43 кг. Присутствие кислорода в горючем газе не только снижает его теплотворную способность, но и, что гораздо важнее, создает взрывоопасную смесь. По этой причине его содержание в магистральных газопроводах также строго лимитировано и, согласно нормативным документам, не должно превышать 1% по объему.
1.3. Одоризация — мера пассивной безопасности
Так как метан и его гомологи практически не имеют запаха, обнаружить утечку чистого природного газа органолептически невозможно. Для обеспечения безопасности в газ, поставляемый в коммунально-бытовой сектор и на промышленные предприятия, добавляют специальные пахучие вещества — одоранты. Этот процесс называется одоризацией. В качестве одоранта чаще всего используется этилмеркаптан (C2H5SH), обладающий резким, крайне неприятным запахом. Нормы одоризации рассчитаны таким образом, чтобы человек мог почувствовать характерный «запах газа» уже при его концентрации в воздухе, в 5 раз меньшей нижнего предела взрываемости (т.е. при концентрации около 1%). Основной стандарт по организации процесса одоризации: ГОСТ Р 52087–2003 — «Газы горючие природные. Общие требования к одоризации».

В таблице 1 представлены данные о влиянии различных концентраций угарного газа (СО) на здоровье человека, что подчеркивает важность контроля за продуктами сгорания.
Таблица 1. Физиологическое воздействие оксида углерода (СО) на организм человека
| Концентрация СО в воздухе | Продолжительность и характер воздействия | |
| объем, % | мг/л | |
| 0,01 | 0,125 | Безопасно при воздействии в течение нескольких часов |
| 0,05 | 0,625 | В течение 1 часа не вызывает заметных симптомов |
| 0,1 | 1,25 | Через 1 час появляются головная боль, тошнота, общее недомогание |
| 0,5 | 6,25 | Смертельное воздействие в течение 20–30 минут |
2. Классификация природных газов

По происхождению и геологии:
- Газовые месторождения (первичные): запасы, где газ накоплен преимущественно в газовой фазе в поровом пространстве коллекторов. Типичные продукты — сухие и влажные газовые смеси, которые добывают и направляют в газоперерабатывающие установки (ГПА).
- Попутный нефтяной газ (ПНГ): газ, связанный с добычей нефти; как правило, содержит повышенные доли тяжёлых углеводородов (C2+), конденсата и примесей (H2S, CO2), требует предварительной очистки и выделения углеводородных фракций.
- Биогаз / синтетические газы: биологического происхождения (метаногенез) или получаемые пиролизом/гидролизом — по составу и применению отличаются и требуют отдельной подготовки к использованию.
По составу и технологическим показателям:
- Сухие (lean) газы: доля метана типично > 90–95 % об.; низкое содержание жидких углеводородов (NGL) и следовых примесей. Используются преимущественно для топливных и энергетических целей.
- Жирные (rich) газы: повышенная доля C2–C4 и выше; представляют ценное сырьё для газохимии (NGL — recovery) и требуют разделения и фракционирования.
- Кислые (sour) газы: содержащие значимые концентрации H2S и/или CO2; требуют сероулавливания (sweetening) и утилизации серы (Claus и пр.).
- «Балластные» или разбавленные: повышенные доли N2 и/или CO2; снижают теплотворную способность и могут требовать удаления перед коммерческой поставкой.
По состоянию хранения и транспорта:
- Газообразное (магистральные потоки, CNG — компримированный природный газ): газ под высоким давлением (типично 20–25 МПа для магистралей, 20–25 МПа и выше для судовых баков/автотранспорта в виде CNG). CNG — технологически оптимален для кратких маршрутов и автомобильного транспорта.
- Сжиженное (LNG / СПГ): при атмосферном давлении и низкой температуре (≈ −161…−162 °C для метана) — объём сокращается примерно в ~600 раз относительно газовой фазы при н.у., плотность жидкого метана порядка 420–430 кг/м³ (приближённо). СПГ обеспечивает эффективную морскую логистику и межконтинентальный экспорт.
3. Единицы измерения ключевых параметров газа
Для корректных инженерных расчетов, коммерческого учета и обеспечения безопасности необходимо использовать стандартизированную систему единиц измерения параметров газа, а также ГОСТ 30319.3-2015 «Газ природный. Методы расчёта физических свойств. Вычисление физических свойств на основе данных о компонентном составе».
Измерение давления газа. В газовой отрасли различают избыточное и абсолютное давление.
Избыточное давление — это давление сверх атмосферного, его измеряют манометрами.
Абсолютное давление равно сумме избыточного и барометрического (атмосферного) давления. Именно абсолютное давление используется в термодинамических расчетах.
В Международной системе единиц (СИ) основной единицей давления является паскаль (Па). 1 Па равен давлению, создаваемому силой в 1 ньютон на площадь в 1 м². На практике широко используются производные единицы: килопаскаль (кПа = 1000 Па) и мегапаскаль (МПа = 1 000 000 Па). В таблице 2 приведены соотношения между различными единицами давления.
Таблица 2. Соотношение между единицами измерения давления
| Обозначение | Па | кгс/cм² (ат) | бар | мм вод. ст. | мм рт. ст. |
| 1 Па | 1 | 1,02·10-5 | 10-5 | 0,102 | 0,0075 |
| 1 кгс/cм² (ат) | 98066,5 | 1 | 0,981 | 10000 | 735,6 |
| 1 бар | 100000 | 1,02 | 1 | 10197 | 750,06 |
| 1 мм вод. ст. | 9,81 | 10-4 | 9,81·10-5 | 1 | 0,0735 |
| 1 мм рт. ст. | 133,32 | 0,00136 | 0,00133 | 13,6 | 1 |
Измерение температуры. Температура — это мера средней кинетической энергии молекул вещества. В инженерной практике используется шкала Цельсия (°C), где 0 °C — точка замерзания воды, а 100 °C — точка кипения при нормальном атмосферном давлении. В термодинамических расчетах и газовых законах применяется абсолютная шкала Кельвина (К). Нуль по шкале Кельвина (0 К) соответствует абсолютному нулю, теоретической точке, где тепловое движение молекул прекращается. Соотношение между шкалами: T (К) = t (°C) + 273,15.
Пример: Если температура дымовых газов составляет 200 °С, то по абсолютной шкале это будет 200 + 273,15 = 473,15 К.
Измерение количества теплоты. В системе СИ универсальной единицей энергии, работы и количества теплоты является джоуль (Дж). На практике удобнее использовать килоджоуль (кДж = 1000 Дж) и мегаджоуль (МДж = 1 000 000 Дж). Исторически использовалась также внесистемная единица — калория (кал) и килокалория (ккал). Соотношение: 1 ккал = 4,1868 кДж.
Удельная теплота сгорания — это количество теплоты, выделяющееся при полном сгорании единицы объема (1 м³) или массы (1 кг) топлива. Различают высшую (QB) и низшую (QH) теплоту сгорания. Высшая учитывает теплоту, выделяющуюся при конденсации водяных паров из продуктов сгорания, а низшая — нет. В расчетах тепловых установок (котлов, печей) принято использовать низшую теплоту сгорания, так как в большинстве случаев водяные пары уходят с дымовыми газами, не конденсируясь.
Примерные формулы для расчета теплоты сгорания природного газа (в ккал/м³) в зависимости от компонентного состава (% по объему):
QB = 95·[CH4] + 167·[C2H6] + 237·[C3H8] + 307·[C4H10]
QH = 85,5·[CH4] + 152·[C2H6] + 218·[C3H8] + 284·[C4H10]
В таблице 3 приведена удобная справка для перевода калорий в джоули.
Таблица 3. Таблица для перевода калорий в джоули (1 кал ≈ 4,187 Дж)
| Калории | Единицы калорий | ||||
| 0 | 1 | 2 | 5 | 8 | |
| Десятки калорий | Значения в Джоулях (Дж) | ||||
| 0 | 0 | 4,2 | 8,4 | 20,9 | 33,5 |
| 10 | 41,9 | 46,1 | 50,2 | 62,8 | 75,4 |
| 20 | 83,7 | 87,9 | 92,1 | 104,7 | 117,2 |
| 50 | 209,3 | 213,5 | 217,7 | 230,3 | 242,8 |
Измерение объема и плотности. Объем газа измеряют в кубических метрах (м³). Поскольку объем газа сильно зависит от температуры и давления, для сопоставимости результатов его приводят к определенным условиям:
- Нормальные условия (н.у.): температура 0 °С (273,15 К) и давление 101,325 кПа (760 мм рт. ст.).
- Стандартные условия: согласно ГОСТ 2939-63, это температура 20 °С (293,15 К) и давление 101,325 кПа при нулевой влажности. Именно в стандартных условиях ведется коммерческий учет газа.
Плотность — это масса единицы объема вещества (кг/м³).
Относительная плотность газа — это безразмерная величина, показывающая, во сколько раз данный газ тяжелее или легче воздуха при одинаковых условиях.
4. Физические и термодинамические свойства природного газа
Основные термодинамические константы (на примере метана):
- Молярная масса метана: M = 16,04·10⁻³ кг/моль.
- Плотность при нормальных условиях (н.у.) (0 °C, 101.325 кПа): ρ₀ ≈ 0,7156 кг/м³. (расчёт: ρ = M / Vm, Vm(0 °C,1атм) = 22,414·10⁻³ м³/моль).
- Удельная газовая постоянная: Rs = Runiv / M ≈ 8,3144626 / 0,01604 ≈ 518,4 Дж/(кг·К).
- Молярная теплоёмкость при постоянном давлении (типичное значение при 298 K): Cp,m ≈ 35,69 Дж/(моль·К) → удельная по массе Cp ≈ 2225,1 Дж/(кг·К).
- Cv ≈ Cp − Rs ≈ 1706,7 Дж/(кг·К); показатель адиабаты γ = Cp / Cv ≈ 1,304 (типичное значение при нормальных условиях).
Скорость звука и её инженерное значение:
Скорость звука в идеальном газе: a = √(γ·Rs·T).
- При T = 273,15 K (0 °C): a ≈ 429,6 м/с.
- При T = 293,15 K (20 °C): a ≈ 445,1 м/с.
Значение скорости звука используется при расчётах акустики трубопроводов, при определении режима течения (субсонный/сверхзвуковой в турбокомпрессорах), а также в методах дистанционного обнаружения утечек и в акустических мониторах работы оборудования.
Реальный газ, коэффициент сжимаемости Z и уравнения состояния:
При давлениях до 1–2 МПа поведение природного газа близко к идеальному; при повышенных давлениях вводится коэффициент сжимаемости Z = pV/(nRT). Для инженерных расчётов используются:
- корелляции и таблицы Z (например, на основе уравнения состояния Редлиха–Квонга или Пенга–Робинсона);
- в прикладной практике — эмпирические корреляции (например, AGA/ISO методики) для вычисления поправок на сжимаемость при коммерческом учёте и проектировании компрессорных цилиндров.
Вязкость, теплоёмкость, вязко‑термальные коэффициенты:
Вязкость газов порядка 10⁻⁵ — 10⁻⁴ Па·с. Для метана при 20 °C характерные значения ≈ 1·10⁻⁵ Па·с. Эти параметры важны при расчётах гидравлического сопротивления, потерь давления в трубах (уравнение Дарси–Вейсбаха) и критериев турбулентности (число Рейнольдса).
Теплотворная способность и индексы качества газа:
- Нижняя теплота сгорания (QH) метана: 35,88 МДж/м³ (≈ 9,967 кВт·ч/м³).
- Относительная плотность по воздуху (молекулярная): ρrel ≈ MCH4 / Mair ≈ 0,554 (воздух ≈ 28,9647 г/моль).
Wobbe‑индекс (Wi) — важный эксплуатационный показатель для заменяемости газов при горении:
Wi = Q / √G
где Q — теплотворная способность, G — относительная плотность (безразмерная). Для чистого метана (используя QH = 35,880 кДж/м³ и G ≈ 0,554) получаем: Wi ≈ 48,215 МДж/м³ (≈ 48 215 кДж/м³). Wobbe‑индекс используется при проектировании горелок и сопел, а также для классификации заменяемости газа.
5. Фундаментальные законы газового состояния
Поведение газов при изменении внешних условий описывается несколькими фундаментальными законами, выведенными для модели «идеального газа». В этой модели предполагается, что молекулы не имеют собственного объема и не взаимодействуют друг с другом. Для реальных газов, таких как природный, эти законы достаточно точны при давлениях до 1-2 МПа. При более высоких давлениях вводятся поправочные коэффициенты (коэффициент сжимаемости).
Закон Бойля – Мариотта (изотермический процесс). Устанавливает, что при постоянной температуре (T = const) объем данной массы газа обратно пропорционален его абсолютному давлению.
Математически это выражается как:
p1V1 = p2V2 = const
Этот закон объясняет, почему при сжатии газа в компрессоре его объем уменьшается, а давление растет. Он также лежит в основе расчетов вместимости газовых баллонов и хранилищ.
Закон Гей-Люссака (изобарный процесс). Описывает поведение газа при постоянном давлении (p = const). Он гласит, что объем данной массы газа прямо пропорционален его абсолютной температуре.
Формула закона:
V1/T1 = V2/T2 = const
Этот закон объясняет, почему газопровод на открытом воздухе летом и зимой при одинаковом давлении пропускает разное массовое количество газа, так как его плотность меняется с температурой.
Закон Шарля (изохорный процесс). Применяется для процессов, протекающих при постоянном объеме (V = const). Он утверждает, что давление данной массы газа прямо пропорционально его абсолютной температуре.
Формула закона:
p1/T1 = p2/T2 = const
Этот закон объясняет, почему нельзя нагревать закрытые газовые баллоны: с ростом температуры давление внутри них может достичь критических значений и привести к взрыву.
6. Сравнительная характеристика различных видов газового топлива
Чтобы лучше понять место природного газа среди других энергоносителей, приведем их сравнительную таблицу.
Таблица 4. Сравнение ключевых характеристик газообразных топлив
| Параметр | Природный газ (≈98% CH4) | Пропан (C3H8) | Водород (H2) |
| Низшая теплота сгорания, МДж/м³ | ~35,9 | ~91,2 | ~10,8 |
| Плотность (н.у.), кг/м³ | ~0,72 | ~2,01 | ~0,09 |
| Относительная плотность по воздуху | ~0,55 (легче воздуха) | ~1,55 (тяжелее воздуха) | ~0,07 (значительно легче воздуха) |
| Пределы воспламенения в воздухе, % об. | 5 — 15 | 2,1 — 9,5 | 4 — 75 |
| Экологичность (продукты сгорания) | CO2, H2O | CO2, H2O (больше CO2 на единицу энергии) | Только H2O |
7. Транспортировка и хранение
7.1. Способы транспортировки:

- Магистральные газопроводы: pipelines: Это основной метод доставки по суше. Газ под высоким давлением (около 7,5 МПа) перемещается по стальным трубам большого диаметра. Через каждые 100-200 км стоят компрессорные станции, которые поддерживают давление.
- Плюс: Надёжно и дёшево для больших объёмов на континенте.
- Минус: Высокие начальные затраты и жёсткая привязка к маршруту.
- Сжиженный природный газ (СПГ / LNG): Газ охлаждают до -162°C, превращая его в жидкость. Его объём уменьшается в 600 раз. В таком виде его перевозят на специальных судах — танкерах-газовозах.
- Плюс: Гибкость. Можно доставить в любую точку мира по морю.
- Минус: Очень дорогой и энергоёмкий процесс (сжижение, перевозка, регазификация).
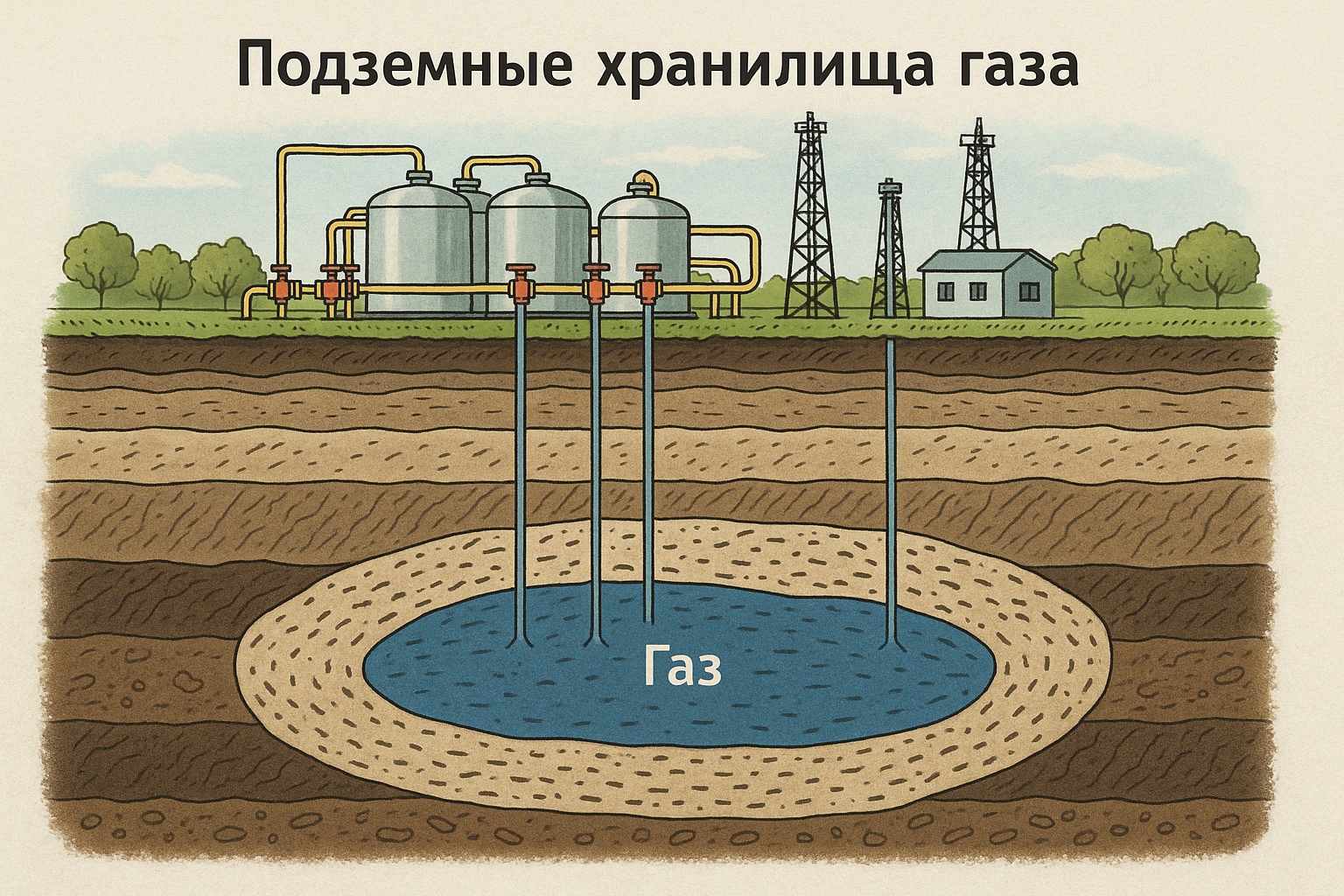
7.2. Способы хранения:
Хранилища нужны, чтобы сглаживать сезонные колебания спроса (зимой нужно больше газа, чем летом).
- Подземные хранилища газа (ПХГ): Самый распространённый способ. Летом излишки газа закачивают под землю, а зимой отбирают. Используют:
- Истощённые месторождения: Старые месторождения, откуда газ уже выкачали.
- Водоносные пласты (аквиферы): Подземные пористые породы, заполненные водой.
- Соляные каверны: Пустоты, созданные в мощных пластах соли.
- СПГ-резервуары: Это огромные наземные изотермические баки («термосы») для хранения газа в сжиженном виде на заводах и приёмных терминалах.
8. Технологические применения природного газа
В современной промышленности природный газ является незаменимым сырьём для производства множества химических продуктов и материалов, определяющих наш технологический уклад.
8.1. Производство водорода и синтез-газа
Одно из важнейших применений метана — производство водорода () и синтез-газа (смеси и ). Основной метод — это паровая конверсия метана.
- Как это работает: Водяной пар () при высокой температуре (700–1000°C) и давлении пропускают через метан в присутствии катализатора (обычно на основе никеля).
Полученный водород является ключевым элементом в нефтепереработке (для очистки нефти от серы) и, что самое главное, в производстве аммиака.
8.2. Сырьё для химической промышленности
Синтез-газ, полученный из метана, служит отправной точкой для синтеза огромного спектра химических веществ.
- Аммиак (): Водород из метана соединяют с азотом из воздуха (процесс Габера-Боша). Аммиак — это основа для производства всех азотных удобрений (селитры, карбамида), без которых невозможно современное сельское хозяйство.
- Метанол (): Синтез-газ преобразуют в метанол, который является базовым химикатом для производства формальдегида, уксусной кислоты, растворителей и пластмасс. Например, из метанола делают полиформальдегид — прочный инженерный пластик, используемый в автомобилестроении.
- Пластмассы: Через более сложные химические цепочки метан становится сырьём для производства полиэтилена и полипропилена — самых массовых видов пластика в мире, из которых делают всё: от упаковки до труб и деталей автомобилей.
8.3. Газомоторное топливо
Природный газ — одна из самых популярных альтернатив бензину и дизелю. Он используется в двух видах:
- Компримированный природный газ (КПГ): Метан, сжатый под давлением 200–250 бар. Используется в легковых автомобилях, автобусах и коммунальной технике.
- Сжиженный природный газ (СПГ): Метан, охлаждённый до -162°C. Используется как топливо для магистральных тягачей, карьерной техники и морских судов, где важен большой запас хода.

Использование газа в качестве топлива значительно снижает выбросы оксидов серы, сажи и оксидов азота по сравнению с традиционными видами топлива.
8.4. Прямое использование в промышленности
Помимо химических превращений, природный газ напрямую используется в высокотемпературных промышленных процессах.
- Металлургия: Газ используется в доменных печах для производства чугуна (частично заменяя дорогой кокс), а также для нагревательных печей в сталепрокатном производстве.
- Производство стекла и цемента: Обжиг сырья в стекольных и цементных печах требует стабильно высоких температур, которые эффективно обеспечивает сжигание природного газа.
Природный газ является фундаментальным строительным блоком для ключевых отраслей промышленности — от агрохимии до производства современных материалов.
9. Экология

Природный газ часто называют самым чистым ископаемым топливом, но его экологическое воздействие неоднозначно и имеет как положительные, так и отрицательные стороны.
9.1. Преимущества по сравнению с другими ископаемыми видами топлива
Основное экологическое преимущество природного газа проявляется при его сравнении с углём и нефтепродуктами.
- Меньше выбросов CO₂: При сжигании природный газ выделяет примерно на 50-60% меньше углекислого газа (CO₂) по сравнению с углём и на 15-20% меньше, чем бензин, для выработки того же количества энергии. Это делает его более предпочтительным топливом в контексте борьбы с глобальным потеплением.
- Чистое горение: В процессе сгорания газа образуется значительно меньше вредных загрязнителей воздуха. Выбросы диоксида серы (SO₂), вызывающего кислотные дожди, и твёрдых частиц (сажи), опасных для здоровья дыхательной системы, практически равны нулю. Также выделяется гораздо меньше оксидов азота (NOx), способствующих образованию смога.
9.2. Основные экологические проблемы
Несмотря на свои преимущества, природный газ представляет и серьезные экологические риски.
- Метан — мощный парниковый газ: Главный компонент природного газа — метан (CH₄). Утечки метана на всех этапах — от добычи и транспортировки до хранения и конечного использования — представляют большую угрозу для климата. Метан является гораздо более мощным парниковым газом, чем CO₂: за 20-летний период его согревающий потенциал в 80 раз выше. Даже небольшие утечки могут свести на нет климатические преимущества от его более чистого сгорания.
- Выбросы CO₂: Хотя при сжигании газа выделяется меньше CO₂, он все равно является ископаемым топливом и вносит значительный вклад в увеличение концентрации углекислого газа в атмосфере, усугубляя парниковый эффект.
- Воздействие на окружающую среду при добыче: Методы добычи, особенно гидравлический разрыв пласта (фрекинг), вызывают серьезные опасения. Этот процесс требует огромного количества воды, может приводить к загрязнению грунтовых вод химикатами, используемыми в процессе, а также провоцировать локальные землетрясения (наведенную сейсмичность).
В итоге, хотя природный газ и является более чистой альтернативой углю и нефти, он не является полностью «зелёным» топливом. Его использование рассматривается многими как «переходный» источник энергии на пути к полностью возобновляемой энергетике, но его долгосрочное применение несовместимо с целями по сдерживанию изменения климата из-за проблемы утечек метана и неизбежных выбросов CO₂.
Интересные факты о природном газе
- Запах газа — искусственный. Как упоминалось, сам метан запаха не имеет. Резкий «газовый» запах, который мы знаем, — это заслуга одоранта этилмеркаптана, который специально добавляют для безопасности.
- Газовые гидраты. На дне океанов и в зонах вечной мерзлоты существуют огромные запасы природного газа в твердом состоянии — в виде газовых гидратов, где молекулы газа «заперты» в кристаллической решетке воды, напоминающей лед.
- Самый глубокий газовый колодец. Глубина некоторых газовых скважин может превышать 10-12 километров, что сопоставимо с высотой полета пассажирского самолета.
- Энергия в малом объеме. Один танкер-газовоз для перевозки СПГ может нести достаточно энергии, чтобы обеспечить электричеством крупный город на протяжении нескольких недель.
Заключение
Природный газ — это сложный продукт, чья эффективность и безопасность напрямую зависят от глубокого понимания его состава и свойств. От процентного содержания метана, определяющего его энергетическую ценность, до микроскопических примесей сероводорода, влияющих на долговечность инфраструктуры, — каждая деталь имеет значение. Знание и применение основных газовых законов позволяет инженерам проектировать надежные системы транспортировки, хранения и потребления. В эпоху энергетического перехода природный газ остается основным элементом, обеспечивающим стабильность и открывающим путь к новым, более чистым технологиям.

