Имплантатами называется класс изделий медицинского назначения, используемых для вживления в организм в роли протезов (заменителей отсутствующих органов человека) либо в качестве идентификаторов (например, чипов с информацией о домашних животных, вживляемых под кожу). В стоматологии используются имплантаты для вживления в кости верхней и нижней челюстей, которые служат в качестве основы для прикрепления стоматологических протезов. Существует также имплантация капсул, содержащих фармацевтические вещества.
Одним из основных требований, предъявляемых к материалам для имплантатов, является биосовместимость, т.е. толерантность к жизненным или биомолекулярным функциям организма. Соответственно, биосовместимыми называют такие материалы, которые обладают способностью функционировать при соответствующей реакции организма хозяина в конкретном случае применения, не вызывая сильного воспаления или некроза окружающих материал тканей.
В настоящее время предлагается множество различных материалов для имплантации, поэтому понимание возможной реакции ткани позволяет специалисту по биоматериалам подобрать тот из них, который будет оптимально функционировать в данном конкретном случае.
В зависимости от реакции ткани на имплантат можно выделить следующие категории материалов, используемых на практике: токсичные, инертные, биоактивные и биорезорбируемые. Токсичные материалы оказывают губительное воздействие на окружающие ткани. Вокруг инертных материалов в организме образуется волокнистая неприлегающая ткань. Биоактивные материалы характеризуются образованием прилегающей межповерхностной связи с тканью. Биорезорбируемые материалы по мере растворения замещаются тканью организма (с образованием нетоксичных продуктов растворения). Инертные, биоактивные и биорезорбируемые материалы относятся к биосовместимым.
При изготовлении имплантатов применяют биосовместимые покрытия, которые являются инертными в отношении биологических объектов или способствуют интеграции небиологических объектов в ткани организма. Обычно такие покрытия наносятся из химически и биологически инертных материалов, безопасных для тканей и организма в целом. Так, нанесение углеродной пленки нанометровой толщины на протезы, имплантируемые в кровеносное русло (клапаны, стенты), позволяет снизить адгезию на них белков крови и тромбоцитов и уменьшает риск образования тромбов у пациента. Покрытие суперпарамагнитных наночастиц оксидов железа слоем золота позволяет получать биосовместимые диагностические и терапевтические наночастицы. Покрытие наноконтейнеров для лекарственной и генной терапии полиэтиленгликолем защищает их от инактивации клетками иммунной системы и позволяет более длительное время циркулировать в кровотоке.
Весьма эффективная биомодификация поверхности материалов обеспечивается изменением поверхностных свойств путем нанесения биоактивных молекул, на которые реагирует окружающая среда на клеточном или молекулярном уровне. Биоактивную поверхность создают, высаживая на подложку биоактивные лиганды, которые могут состоять из рецепторов клеточных мембран, антител, адгезионных пептидов, ферментов, клейких углеводов, лектина, мембранных липидов и компонентов матричных гликозаминогликанов.
Особый интерес представляет нанесение на поверхность костных имплантатов пленочных покрытий из полимерного материала полипиррола, которые можно применять в качестве электрически контролируемого устройства для выделения лекарственных препаратов. Антибиотики или противовоспалительные средства, введенные в такое покрытие, могут выделяться из него «по требованию» (при подаче электрического напряжения) и подавлять воспалительные процессы, убивая бактерии.
В последнее время разрабатывается перспективное направление в области биосовместимых материалов – активная интеграция небиологических материалов в живую ткань. Такая интеграция весьма желательна, в частности, при имплантации искусственных суставов, которые должны обеспечивать длительный и надежный контакт с тканями организма. Например, одним из распространенных способов «вживления» металла или пластика в биологическую ткань является его обработка молекулами, входящими в состав внеклеточного матрикса, например, фибронектином, который играет роль тканевого клея и стимулирует адгезию клеток соединительной ткани к инородному материалу.
В травматологии, ортопедии и широко в стоматологии применяются костные имплантаты, представляющие собой специально изготавливаемые изделия, которые вживляются в кость. Одной из основных проблем применения имплантатов являются тяжелые последствия, наблюдаемые при их отторжении организмом человека. Поэтому важным требованием, предъявляемым к ним, является способность адаптироваться к костной структуре в условиях ее функционирования в течение длительного времени.
Принято различать биохимическую и биомеханическую адаптивность имплантатов.
Для обеспечения биохимической адаптивности имплантаты изготавливают из материалов, которые не вызывают нарушений в обычном характере протекания биохимических процессов в организме, включая восстановительные процессы. В частности, такие биоинертые материалы не должны растворяться, подвергаться коррозии и структурным изменениям в жидких средах организма, а также деградации, связанной с жизнедеятельностью организма. Кроме того, они не должны вызывать нежелательные химические превращения в организме и оказывать отрицательное влияние на клеточную и тканевую реакции заживления.
Как правило, каждый имплантат создается применительно к индивидуальным особенностям организма, в который он будет вживлен. Поэтому перед инсталляцией имплантата весьма эффективно осуществлять процесс его индивидуальной биологической адаптации в специальном биологическом реакторе, где проводится «подгонка» имплантата в результате изучения взаимодействия его материала и биологических компонентов, присущих предполагаемому больному. Благодаря этому вне организма достигается «привыкание» имплантата, что позволяет осуществлять рациональный выбор материала имплантата, уменьшая его возможное отрицательное влияние на органы и ткани больного при его вживлении в организм.
Для обеспечения биомеханической адаптивности имплантаты изготавливают из материалов, способных выдерживать значительные механические нагрузки, которым подвергаются кости.
В наиболее полной мере указанным выше требованиям удовлетворяет титан, а также керамика на основе оксида алюминия Al2O3. Соответственно, эти материалы получили наиболее широкое распространение при изготовлении костных имплантатов.
Для успешного применения имплантата важно обеспечить адаптивное формирование его контакта с костной структурой, которое определяется конструктивными особенностями имплантата, в частности, его размерами и формой, а также качеством поверхности. Так, наилучшее сочленение имплантата корня зуба и альвеолы (зубной лунки в челюсти, в которой находится корень зуба) может быть достигнуто, если корень зуба максимально соответствует альвеоле по размерам и форме.
Оптимальным вариантом проявления биосовместимости имплантатов является непосредственный контакт между поверхностью имплантатов и структурными единицами кости (остеонами компактного и трабекулами губчатого слоёв). При этом обеспечивается практически неподвижное по отношению друг к другу сочленение имплантата с окружающей костной тканью. Такое сочленение проявляется в виде физической и физико-химической связи между костной структурой и поверхностью имплантата, т.е. в виде остеоинтеграции – сращивания имплантата с живой костью. Принято считать, что внутрикостный имплантат может успешно функционировать, если не менее 40–50 % площади его поверхности имеют остеоинтегрированный контакт.
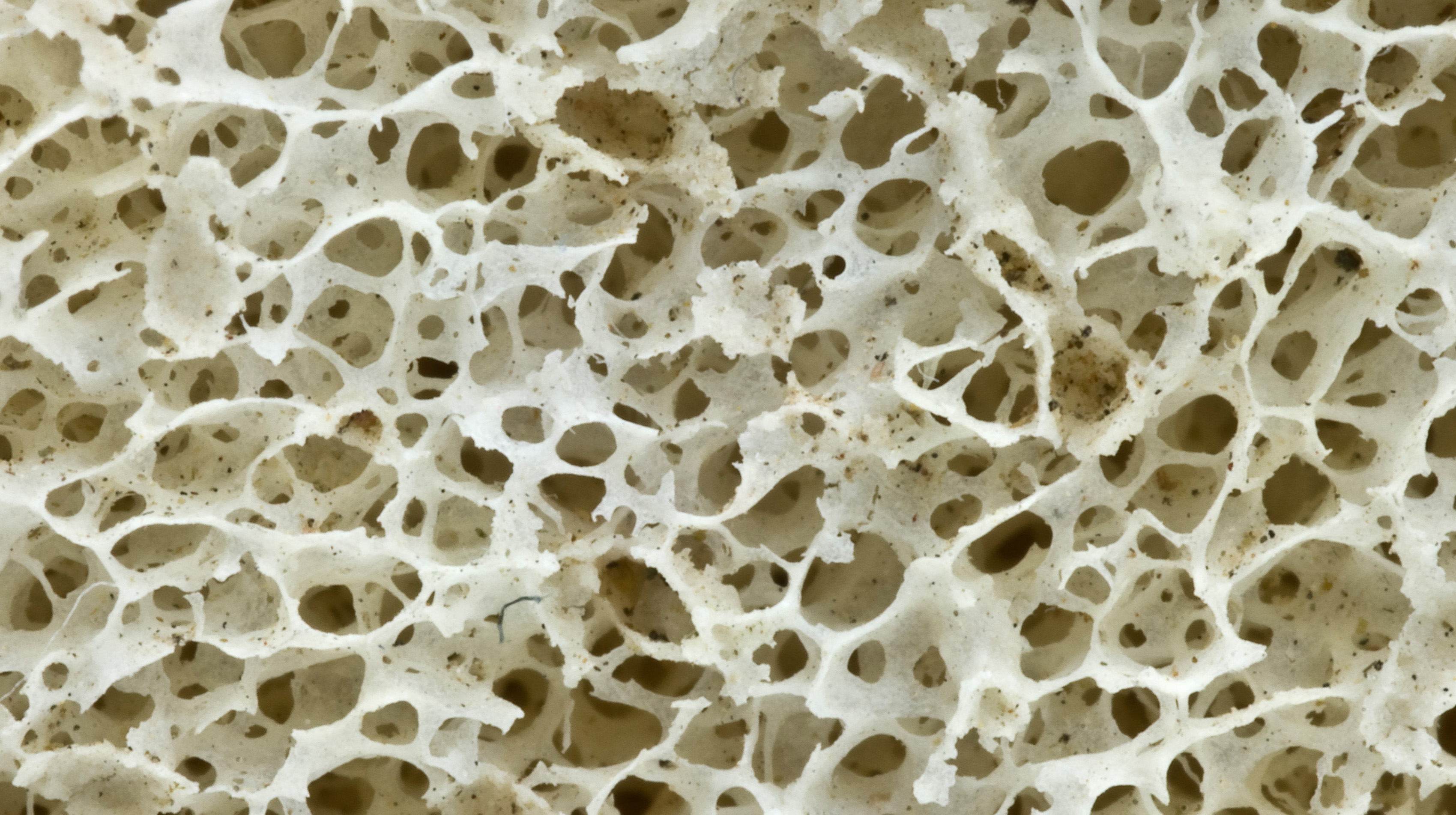
Рис. 1. Пористая структура костной ткани
Кости характеризуются пористой структурой (рис. 1). Поэтому для усиления сцепления имплантата с костью его поверхность делают шероховатой, для чего ее подвергают механической обработке (фрезерование, пескоструйная обработка, рельефная формовка или накат). Более значительному ускорению процессов остеоинтеграции способствует формирование на поверхности имплантата пористой структуры, подобной той, которую имеют кости. Предпочтительно создавать пористую структуру поверхности имплантата с размерами пор в пределах 50– 150 мкм, поскольку в этом случае становится возможным прорастание костной ткани в имплантат, благодаря чему обеспечивается прочная и долговременная (практически пожизненная) фиксация имплантата в кости. Такая структура может быть создана методами порошковой металлургии, например, в результате спекания сферических частиц порошка титана (рис. 2 и 3).
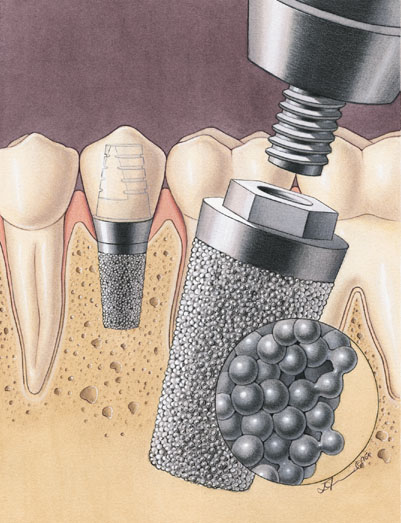
Рис. 2. Зубные имплантаты (штифты) из титана с пористой поверхностью

Рис. 3. Прорастание костной ткани в пористую часть имплантата, образованную сферическими частицами титана
Для повышения качества сцепления титанового имплантата с костью его поверхность покрывают тонким слоем биоактивного материала – гидроксиапатита Са5(ОН)(РО4)3, который обладает особенно высокой биосовместимостью с костной тканью благодаря тому, что является структурным аналогом минеральных компонентов, составляющих основу костной ткани. При этом костная ткань непосредственно врастает в гидроксиапатитный слой.
Наивысшая степень встраивания имплантата в кость может быть достигнута при его изготовлении из биодеградируемых материалов, которые способны растворяться в организме и по мере растворения замещаться прорастающей костной тканью. Важно заметить, что образующиеся при этом продукты растворения являются нетоксичными и выводятся из организма естественным путем. К материалам данного типа относятся композиционные материалы на основе гидроксиапатита и коллагенового волокна (белкового вещества, составляющего основу соединительных тканей организма).
История развития биоматериалов для костных имплантатов берет свое начало с 1900-х годов. В то время ставилась задача выявить принципиальные возможности использования искусственных материалов в протезировании. Осознание того, что такие возможности существуют, явилось следствием наблюдения многочисленных фактов длительного (на протяжении ряда лет) пребывания инородных металлических предметов типа пуль или шрапнели в теле человека. С учетом этого стали предприниматься попытки по созданию костных имплантатов на основе металлов. Их применение существенно расширилось после изобретения нержавеющей стали и хромокобальтовых сплавов, характеризующихся высокой стойкостью к коррозии, продукты которой неблагоприятно воздействуют на организм. Со времен Второй мировой войны было известно, что летчики, получившие проникающие ранения осколками стекол из полиметилметакрилата (ПММА), называемого также оргстеклом, после заживления ран не страдали от отравления этим материалом. На основе этого наблюдения в 1950-е годы ПММА начали применять при протезировании, в частности, в качестве клеящего материала для фиксации протезов из нержавеющей стали. С 1960-х годов для изготовления имплантатов широко используется титан, имеющий более высокую биосовместимость по сравнению с нержавеющей сталью и хромокобальтовыми сплавами.
К перспективным материалам для костных имплантатов, способным срастаться с живой костью, относятся биостекла, широкое применение которых началось с 1970-х годов. Они используются для создания искусственных косточек среднего уха и зубных лунок (челюстных альвеол), искусственных позвонков, подвздошных костей и гранул для заполнения дефектов костей.
Несмотря на достоинства биоматериалов, лучшим «материалом» для любого человеческого органа остается здоровая живая ткань. Поэтому современной философией разработки биоматериалов является инженерия живых тканей, которая нацелена на создание функциональных тканей, заменяющих или улучшающих работу больных и патологических частей организма. Практически эта цель достигается путем выращивания живых клеток на биоматериале в присутствии биоактивных молекул, после чего живые клетки и производимую ими внеклеточную матрицу вместе с подложкой вводят в организм как единую структуру.
Тканевая инженерия начала свою историю в первой половине XX века. В настоящее время она является одной из наиболее молодых отраслей в медицине, базирующейся на принципах молекулярной биологии и генной инженерии. Используемый в ней междисциплинарный подход направлен в первую очередь на создание новых композиционных биоматериалов для восстановления утраченных функций отдельных тканей или органов в целом. Основные принципы этого подхода заключаются в разработке и применении при имплантации в поврежденный орган или ткань носителей из биодеградирующих материалов, которые используются в сочетании либо с донорскими клетками и/или с биоактивными веществами.
Например, при лечении раневого процесса это могут быть коллагеновые покрытия с аллофибробластами, а в сосудистой хирургии – искусственные сосуды с антикоагулянтами.
Одним из важных требований к материалам-носителям такого рода является то, что они должны обеспечивать надежную поддерживающую, то есть опорную и/или структурообразующую функцию в поврежденной области ткани или органа. К наиболее распространенным материалам с четко выраженной опорной функцией относятся гидроксиапатит, биокерамика, полигликолевая кислота, коллагеновые белки.
В настоящее время значительную часть биоматериалов для восстановления костных дефектов получают из хрящевой и/или костной тканей человека или различных животных. Нередко для изготовления композиционных материалов используют компоненты и других видов соединительной ткани – кожи, сухожилий, мозговой оболочки и т.д.
Одним из наиболее известных современных биоматериалов является коллаген, широкое применение которого в практической медицине связано с развитием реконструктивной хирургии и поиском новых материалов, выполняющих каркасную и пластическую функции при регенерации тканей. К основным достоинствам коллагена как пластического биоматериала относятся его низкая токсичность и антигенность, высокая механическая прочность и устойчивость к тканевым протезам.
На основе коллагена разработаны различные изделия медицинского назначения (имплантаты, покрытия для ран, хирургические нити для ушивания раневых поверхностей и т.д.). Вместе с тем, для замещения дефектов костной ткани применяются композиционные биоматериалы, содержащие одновременно и коллаген, и гидроксиапатит.
Как показывает практика, наиболее подходящими материалами для трансплантации и последующей биоинтеграции являются аутотрансплантаты, которые получают из собственных тканей пациента и этим полностью исключаются основные иммунологические и большинство инфекционных осложнений при последующей пересадке. Однако такие материалы должны готовиться непосредственно перед трансплантацией, в противном случае клиника должна иметь костный банк для хранения таких материалов.
