К биолюминесцентным материалам (биолюминофорам) относятся такие материалы, которые обладают способностью к биолюминесценции – разновидности хемилюминесценции, протекающей в живых организмах.
Светящиеся виды встречаются как среди одноклеточных организмов (бактерии, жгутиконосные водоросли и др.), так и среди многоклеточных (грибы, медузы, кальмары, рыбы, рачки, жуки, черви, комары и др.) (рис. 1).

Рис. 1. Биолюминесценция медузы
Многоклеточные животные обычно излучают свет не всем телом, а только специальными клетками фотоцитами, которые часто сгруппированы в особые органы свечения – фотофоры. Биолюминесценция живых организмов выполняет определенные функции: привлечение добычи или партнёров, предупреждение или угроза, отпугивание или отвлечение, маскировка на фоне естественных источников света и др.
Исследование биолюминесценции имеет давнюю историю. Свечение живых организмов отмечалось ещё античными авторами. Так, древнеримский писатель Плиний Старший в своей «Естественной истории» упоминал свечение морских организмов. Однако изучение природы биолюминесценции берёт своё начало в 1668 г., когда английский химик и физик Р. Бойль, изучая процессы горения, обнаружил сходство между процессами горения угля и свечением гнилушек.
Значительный вклад в исследование механизмов биолюминесценции внес французский ученый Р. Дюбуа. В 1887 г. он поставил эксперимент с экстрактами из светящихся жуков Pyrophorus и обнаружил, что экстракт тканей фотофоров светляков, полученный гомогенизацией в холодной воде, светится в течение нескольких минут, однако экстракт, приготовленный в горячей воде, не светится. Вместе с тем Дюбуа установил, что если добавить к потухшему холодному экстракту порцию несветящегося горячего экстракта, то свечение возобновляется. Таким образом, за свечение были ответственны две фракции: устойчивая к нагреву низкомолекулярная, и белковая, теряющая активность при нагревании; свечение in vitro возникало только в присутствии обеих фракций и в присутствии кислорода. Аналогичные результаты Дюбуа получил и в эксперименте со светящимися моллюсками Pholas dactylus. Такое поведение типично для систем фермент – субстрат, поэтому Дюбуа назвал низкомолекулярную фракцию люциферином, а белковую – люциферазой (названия образованы от латинского luciferos – «несущий свет») и постулировал ферментативную природу реакций, вызывающих биолюминесценцию.
Работы Дюбуа положили основу для дальнейших исследований биолюминесценции, в ходе которых оказалось, что у различных групп организмов существует множество систем люциферин – люцифераза. Американский зоолог Э.Н. Харви в 1920 г. при изучении биолюминесценции ракообразных показал различие люциферазных субстрат-ферментных систем различных таксонов: люциферин моллюсков Pholas не светился под действием люциферазы ракообразных Cypridina и наоборот, люцифераза Pholas была неактивна по отношению к люциферину Cypridina. В 1957 г. был выделен и охарактеризован люциферин светляков, оказавшийся производным тиазола.
В конце 1950-х – начале 1960-х гг. японско-американский учёный в области органической химии и морской биологии О. Симомура исследовал механизм свечения остракод Cypridina hilgendorfii (класс ракообразных), которые использовались во время Второй Мировой Войны японцами как природный люминофор: высушенные рачки при смачивании снова начинали светиться. При этом ему удалось выделить из них в чистом кристаллическом состоянии новый люциферин, отличающийся от люциферина светляков. В качестве объекта дальнейших исследований биолюминесценции он избрал медузу Aequorea victoria, фотофоры которой излучают зелёный свет. Симомура выделил из медуз белок экворин и показал, что биолюминесценция экворина инициируется ионами кальция, при этом, в отличие от классической биолюминесценции, для излучения света экворином кислород не требовался. Это стало открытием нового класса биолюминесцентных систем – фотопротеинов, в которых светоизлучающий фрагмент является не свободным субстратом – люциферином, а небелковым компонентом, прочно связанным с белком. Симомура также обнаружил, что выделенный из медузы и очищенный экворин in vitro («в пробирке» – вне живого организма) излучает синий свет, в то время как живая медуза светится зелёным. Последующие исследования показали, что за зелёное свечение ответственен другой белок – GFP (англ. green fluorescent protein – зелёный флуоресцентный белок), светящийся зелёным цветом под действием голубого излучения экворина. В дальнейшем и экворин, и GFP вошли в лабораторную практику молекулярной биологии, первый – как индикатор присутствия ионов Ca2+, второй – в качестве флуоресцентной метки для изучения клеточных белков. За работы по GFP Симомура был удостоен Нобелевской премии по химии 2008 года.
Как отмечалось выше, биолюминесцентные реакции представляют собой окисление некоторого вещества – люциферина, катализируемое специальным ферментом – люциферазой. Во время такого ферментативного окисления люциферина выделяется большое количество энергии, переводящее промежуточный продукт этой реакции в возбужденное состояние (рис. 2).
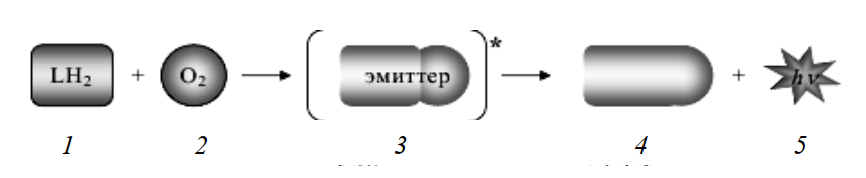
Рис. 2. Схема биолюминесцентной реакции в активном центре люциферазы: 1 – люциферин; 2 – кислород; 3 – промежуточный продукт в возбужденном Состоянии; 4 – окисленный люциферин; 5 – квант света (фотон)
Явление биолюминесценции лежит в основе биолюминесцентного анализа. Различают избирательный биолюминесцентный анализ и биолюминесцентные интегральные тесты. В первом случае по интенсивности биолюминесценции судят о концентрации определенного вещества в анализируемом объекте, во втором – по свечению делают вывод об общей токсичности исследуемого образца для живых организмов.
Хорошо известно свечение светляков, которое происходит в результате биохимической реакции окисления светлякового люциферина кислородом воздуха в присутствии аденозинтрифосфорной кислоты (ATФ). На этом основан один из самых чувствительных методов анализа АТФ в различных объектах. Для определения содержания АТФ измеряют биолюминесценцию в изучаемом растворе, к которому добавляют смесь люциферина и люциферазы. Поскольку биосинтез АТФ является показателем нормальной жизнедеятельности клеток, то препарат люциферин – люцифераза светляка используют для обнаружения бактериального заражения в какойлибо среде, для оценки жизнеспособности эритроцитов при консервировании крови, изучения действия антибиотиков на микроорганизмы и т.д.
Для обнаружения малых количеств ионов кальция широко используется биолюминесценция белка, выделенного из медузы Aequorea.
Все большее распространение получают биолюминесцентный анализ, в котором роль тест-объекта выполняют бактериальные клетки (в суспензии), экстракты светящихся бактерий. Биолюминесцентные тесты с использованием природных светящихся бактерий основаны на высокой чувствительности этих микроорганизмов к разнообразным веществам. В частности, светящиеся бактерии очень чувствительны к изменению концентрации кислорода, что позволяет с их помощью определять его содержание в смесях газов и жидкостях. Разработаны биолюминесцентные методы исследования оксигенирования миоглобинов и гемоглобинов, активности цитохромоксидазы митохондрий и других кислородзависимых процессов и явлений.
Светящиеся бактерии можно также применять для изучения действия токсических веществ. Бактерии чувствительны к примесям токсических веществ в воде, поэтому, измеряя их биолюминесценцию, можно оценивать загрязнение воды токсическими веществами, например, ионами тяжелых металлов. Кроме того, свечение бактерий можно использовать для предварительной оценки эффективности новых антибиотиков.
В настоящее время биолюминесцентный анализ широко применяется в клинической диагностике, при разработке лекарственных средств, для контроля окружающей среды и проверки качества пищи и ее гигиенического состояния.
Разрабатываются высокоэффективные биолюминесцентные системы визуализации биологических процессов на основе сверхчувствительных видеокамер, способных не только регистрировать сигнал интенсивностью в считанные фотоны, но и определять локализацию этого сигнала на исследуемой поверхности. Визуализация биологических процессов начинается с того, что биолюминесцентные системы внедряются в клетки, ткани, органы исследуемых объектов, после чего с помощью видеокамеры следят за развитием пространственного распределения свечения, его спектрального состава. Таким образом, становится возможным наблюдать за развитием вирусных инфекций и опухолей, за приживлением трансплантированных тканей.
Ведется поиск новых соединений, обладающих способностью вступать в химические реакции, сопровождающиеся свечением, с химически активными продуктами жизнедеятельности живых клеток.
