Содержание страницы
Металлы — фундаментальная основа нашей цивилизации. От медных орудий древности до титановых компонентов космических кораблей, эти материалы формировали и продолжают формировать технологический прогресс. Понимание их природы, от субатомного уровня до макроскопических свойств, является ключом к созданию надежных машин, грандиозных сооружений и инновационных технологий. Но что же такое металл на самом деле? Ответ на этот вопрос многогранен и лежит на стыке химии, физики и инженерного дела.
Исторически первые шаги в систематизации знаний о металлах были сделаны великими умами прошлого. Одним из ярчайших примеров является труд русского ученого-энциклопедиста М. В. Ломоносова (1711–1765). В своей работе «Первые основания металлургии или рудных дел» (1763 г., а не 1773 г.), он дал одно из первых научных определений: «Металлом называется светлое тело, которое ковать можно». На тот момент науке было известно лишь шесть таких тел: золото, серебро, медь, олово, железо и свинец. Сегодня же периодическая таблица Д. И. Менделеева насчитывает более 90 химических элементов, обладающих металлическими свойствами, и современная наука рассматривает их с гораздо более глубоких позиций.

1. Определение и современная классификация металлов
Единого, всеобъемлющего определения металла не существует. Его суть раскрывается через призму различных научных дисциплин, каждая из которых подсвечивает свои уникальные аспекты.
- С точки зрения химии, металлы — это элементы, расположенные в левой и центральной частях периодической системы. Их ключевая особенность — малое число электронов на внешней валентной оболочке. Эти электроны слабо связаны с ядром и способны легко отрываться, образуя положительные ионы. Эта особенность определяет их способность вступать в химические реакции в качестве восстановителей и формировать особый тип связи — металлическую связь, где валентные электроны обобществляются, создавая «электронный газ», который и скрепляет ионы в единую структуру.
- Физика определяет металлы как конденсированные среды, обладающие характерным набором свойств. К ним относятся высокий коэффициент отражения света (металлический блеск), пластичность, высокая тепло- и электропроводность, обусловленная свободным движением электронов. Металлы способны плавиться и кристаллизоваться, а также проявлять магнитные свойства.
- Для инженерии и техники металлы — это прежде всего конструкционные материалы. Здесь на первый план выходят их механические и технологические свойства: прочность, твердость, упругость, ударная вязкость. Не менее важна и их обрабатываемость — способность поддаваться ковке, прокатке, штамповке, резанию, сварке и пайке, что позволяет создавать из них изделия сложнейших форм.
В природе металлы встречаются как в самородном виде (золото, платина, реже серебро и медь), так и в виде химических соединений — руд. Наиболее распространены оксиды (соединения с кислородом), сульфиды (с серой) и карбонаты. Именно из этих руд металлургическая промышленность извлекает металлы, которые затем становятся основой для тысяч различных сплавов. Наиболее востребованными в мировой экономике являются железо, алюминий и медь, а также сплавы на их основе.
1.1. Основные группы металлов: черные и цветные
Все многообразие металлов и сплавов принято делить на две большие технологические группы, что закреплено в том числе и в нормативной документации, например, в классификаторах продукции.
Черные металлы

Это обширная группа, основу которой составляют железо (Fe) и его сплавы (стали, чугуны). Характерными чертами этой группы являются темно-серый цвет, высокая плотность, значительная прочность и твердость, а также относительно высокая температура плавления. Ключевой особенностью многих черных металлов является полиморфизм (аллотропия) — способность изменять тип кристаллической решетки при изменении температуры, что лежит в основе их термической обработки.
В соответствии с физико-химическими свойствами, черные металлы делят на несколько подгрупп:
- Железистые металлы: железо (Fe), кобальт (Co), никель (Ni) и марганец (Mn). Кроме марганца, эти металлы являются ферромагнетиками — они способны сильно намагничиваться во внешнем магнитном поле.
- Тугоплавкие металлы: это металлы с температурой плавления выше, чем у железа (1539 °С). Сюда входят вольфрам (W, tпл=3422 °С), молибден (Mo), тантал (Ta), хром (Cr), титан (Ti) и другие. Их основное применение — легирующие добавки для придания сталям жаропрочности, износостойкости и коррозионной стойкости, а также для создания специальных, в том числе твердых сплавов.
- Урановые металлы (актиниды): уран (U), торий (Th), плутоний (Pu). Эта группа используется преимущественно в атомной энергетике и военной промышленности.
- Редкоземельные металлы (РЗМ, лантаноиды): лантан (La), церий (Ce), неодим (Nd), иттрий (Y) и другие. Используются в электронике, производстве магнитов, катализаторов и специальных стекол.
- Щелочноземельные металлы: кальций (Ca), стронций (Sr), барий (Ba) и др. В чистом виде применяются реже, но играют важную роль в металлургии в качестве раскислителей и модификаторов.
Наибольшее промышленное значение имеют железистые и тугоплавкие металлы, формирующие основу для конструкционных материалов, таких как углеродистые стали (регламентируются, например, ГОСТ 380-2005) и легированные стали (например, по ГОСТ 4543-2016).
Цветные металлы

К этой группе относятся все остальные металлы и их сплавы. Их название обусловлено характерной окраской (красный у меди, желтый у золота) или ее отсутствием (серебристо-белый у алюминия, олова, цинка). В отличие от черных металлов, они часто обладают уникальными свойствами: высокой коррозионной стойкостью, превосходной электро- и теплопроводностью, низкой плотностью.
По свойствам и назначению цветные металлы условно делят на:
- Тяжелые: медь (Cu), свинец (Pb), цинк (Zn), олово (Sn), никель (Ni).
- Легкие: алюминий (Al), магний (Mg), титан (Ti), бериллий (Be). Сплавы на основе алюминия, классифицируемые по ГОСТ 4784-2019, незаменимы в авиации и транспорте.
- Благородные: золото (Au), серебро (Ag), платина (Pt) и металлы платиновой группы. Отличаются высокой химической стойкостью и используются в ювелирном деле, электронике и катализе.
2. Внутренний мир металлов: атомно-кристаллическое строение
Ключевые свойства металлов напрямую определяются их внутренним строением. В отличие от газов, где атомы хаотично движутся, или жидкостей с их «ближним порядком», в твердом состоянии атомы металла выстраиваются в строгую, упорядоченную трехмерную структуру, именуемую кристаллической решеткой.
Представьте себе бесконечный каркас, построенный из повторяющихся элементарных блоков. Таким блоком является элементарная кристаллическая ячейка — наименьшая геометрическая фигура, многократным повторением которой в пространстве образуется вся решетка. Расположение атомов в узлах этой решетки и определяет фундаментальные свойства материала.
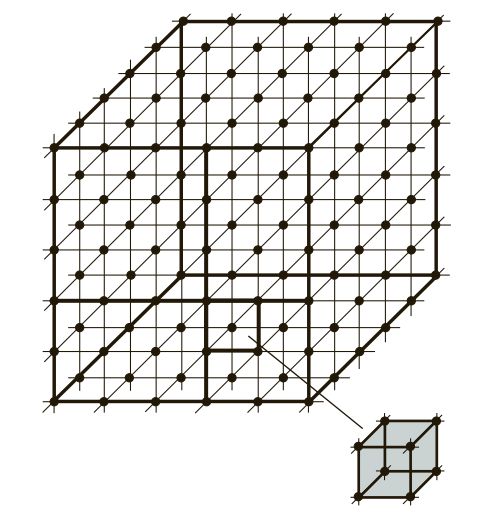
Рис. 1. Схематическое изображение расположения элементарных ячеек в структуре металла
Эта упорядоченная структура пронизана кристаллографическими плоскостями — воображаемыми плоскостями, проходящими через узлы решетки. Именно вдоль этих плоскостей происходит деформация металла.
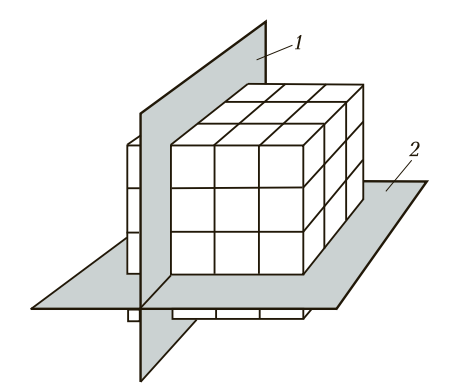
Рис. 2. Расположение кристаллографических плоскостей: 1 — горизонтальная плоскость, 2 — вертикальная плоскость
Основными параметрами элементарной ячейки являются ее реберные длины (периоды решетки) и углы между ними, а также координационное число — количество ближайших, равноудаленных «соседей» у каждого атома. Для металлов наиболее характерны несколько типов кристаллических решеток.
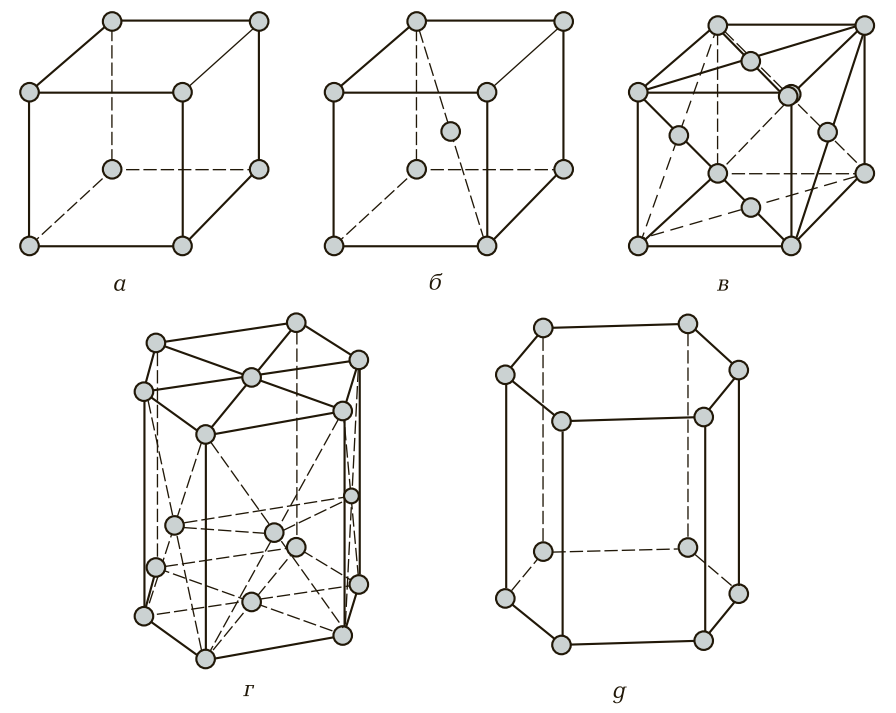
Рис. 3. Основные типы элементарных кристаллических ячеек: а — простая кубическая; б — объемно-центрированная кубическая (ОЦК); в — гранецентрированная кубическая (ГЦК); г — гексагональная плотноупакованная (ГПУ); д — простая гексагональная
- Объемно-центрированная кубическая (ОЦК) ячейка (рис. 3, б). Содержит 9 атомов: 8 по вершинам куба и один в его центре. Такая структура характерна для альфа-железа (Fe-α), хрома, вольфрама, молибдена. Металлы с ОЦК-решеткой обычно обладают высокой прочностью и твердостью, но меньшей пластичностью.
- Гранецентрированная кубическая (ГЦК) ячейка (рис. 3, в). Состоит из 14 атомов: 8 в вершинах куба и 6 в центрах каждой из граней. Такую решетку имеют гамма-железо (Fe-γ), алюминий, медь, никель, золото, серебро. ГЦК-структура является плотноупакованной, что обеспечивает металлам высокую пластичность и ковкость.
- Гексагональная плотноупакованная (ГПУ) ячейка (рис. 3, г). Это 17-атомная структура в виде шестигранной призмы. Ее имеют магний, цинк, титан, кадмий. Металлы с ГПУ-решеткой часто проявляют анизотропию свойств и могут быть хрупкими при определенных условиях.
Связь между атомами в решетке обеспечивается «электронным газом» — это и есть металлическая связь. Ее прочность определяет механические свойства: чем сильнее связь, тем прочнее и тверже металл.
2.1. Сравнительные характеристики кристаллических решеток
Для более глубокого понимания того, как тип решетки влияет на свойства металла, рассмотрим их ключевые параметры в сравнительной таблице.
| Характеристика | Объемно-центрированная (ОЦК) | Гранецентрированная (ГЦК) | Гексагональная плотноупакованная (ГПУ) |
|---|---|---|---|
| Координационное число | 8 | 12 | 12 |
| Коэффициент компактности (плотность упаковки атомов) | 0,68 (рыхлая) | 0,74 (плотная) | 0,74 (плотная) |
| Типичные механические свойства | Высокая прочность, умеренная пластичность, склонность к хладноломкости. | Высокая пластичность, хорошая ковкость, вязкость. | Высокая прочность, ограниченная пластичность, выраженная анизотропия. |
| Примеры металлов | Fe-α, Cr, W, Mo, V, Nb, Ta | Fe-γ, Al, Cu, Ni, Ag, Au, Pb | Mg, Zn, Ti-α, Cd, Co-α, Be |
2.2. Анизотропия — зависимость свойств от направления
Анизотропия (от др.-греч. ἄνισος — неравный и τρόπος — направление) — это неодинаковость физико-механических свойств материала в разных направлениях. Для монокристалла металла это явление естественно: плотность расположения атомов на разных кристаллографических плоскостях и в разных направлениях различна. Следовательно, и прочность, и упругость, и другие характеристики будут зависеть от того, как приложена нагрузка относительно осей кристалла.
Например, предел прочности монокристалла меди вдоль одной оси может быть вдвое выше, чем вдоль другой. В обычных поликристаллических металлах, состоящих из множества разноориентированных зерен (кристаллитов), анизотропия отдельных зерен усредняется, и материал ведет себя как изотропный. Однако в процессе обработки давлением (прокатка, волочение, ковка) зерна вытягиваются в одном направлении, создавая так называемую текстуру. Это приводит к появлению анизотропии уже на макроуровне, что необходимо учитывать при проектировании изделий.
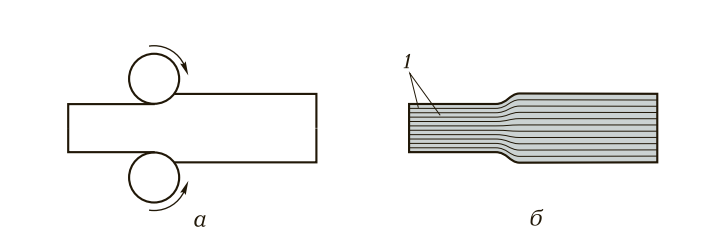
Рис. 4. Схема деформации металлов при прокатке (а) и механизм скольжения атомных слоев по кристаллографическим плоскостям (б)
Способность металлов пластически деформироваться без разрушения — одно из важнейших их свойств. В основе этого процесса лежит скольжение одних атомных плоскостей относительно других, как показано на рис. 4, б.
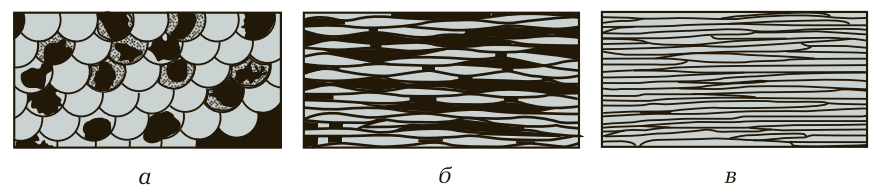
Рис. 5. Изменение микроструктуры металла в процессе деформации: а — исходная структура с равноосными зернами; б — промежуточная стадия; в — конечная волокнистая структура после значительной деформации
2.3. Процесс кристаллизации: рождение твердого металла
Переход металла из жидкого состояния в твердое называется первичной кристаллизацией. Этот сложный процесс протекает в два этапа:
- Зарождение центров кристаллизации. При охлаждении расплава ниже температуры плавления в нем спонтанно образуются мельчайшие устойчивые зародыши твердой фазы.
- Рост кристаллов. Вокруг этих центров начинают расти кристаллы, присоединяя атомы из жидкой фазы. Они растут до тех пор, пока не столкнутся со своими «соседями».
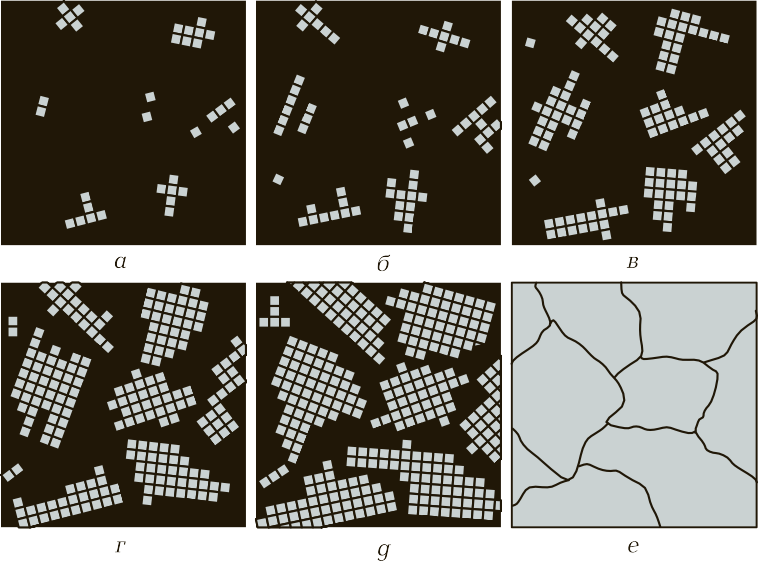
Рис. 6. Последовательные этапы процесса кристаллизации: а-в — зарождение и независимый рост кристаллов; г-е — столкновение кристаллов и формирование границ зерен
Форма и размер конечных кристаллов (зерен) критически влияют на свойства металла. Скорость охлаждения — ключевой фактор управления структурой. Быстрое охлаждение приводит к образованию множества центров кристаллизации и, как следствие, к формированию мелкозернистой структуры. Такой металл обладает повышенной прочностью и твердостью. Медленное охлаждение, наоборот, способствует росту небольшого числа кристаллов до крупных размеров, что дает крупнозернистую структуру, обычно более пластичную, но менее прочную.
2.4. Аллотропия: превращения в твердом состоянии
Некоторые металлы, такие как железо, титан, кобальт, обладают уникальной способностью изменять тип своей кристаллической решетки, оставаясь в твердом состоянии. Это явление называется аллотропией или полиморфизмом, а сам процесс — вторичной кристаллизацией.
Каждая из существующих структур (модификаций) устойчива в своем интервале температур. Переход из одной модификации в другую происходит при строго определенных температурах, называемых критическими точками. Эти превращения обозначаются греческими буквами: α (альфа) для низкотемпературной фазы, β (бета), γ (гамма) и т.д. для последующих высокотемпературных фаз.
Явление аллотропии имеет колоссальное практическое значение, так как лежит в основе термической обработки сталей. Например, железо при комнатной температуре имеет ОЦК-решетку (α-Fe), а при нагреве выше 911 °С переходит в ГЦК-решетку (γ-Fe). Это превращение позволяет закаливать сталь, многократно увеличивая ее прочность и твердость.
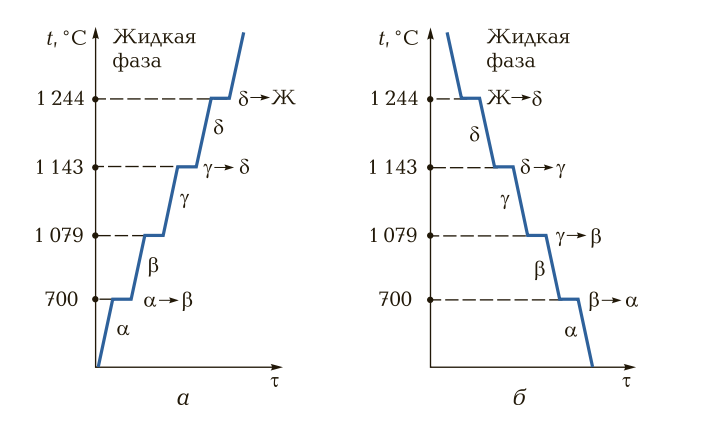
Рис. 7. Кривые нагрева (а) и охлаждения (б) для марганца, демонстрирующие наличие нескольких аллотропических превращений в критических точках
| Металл | Аллотропная модификация | Температурный интервал устойчивости, °С | Тип кристаллической решетки |
|---|---|---|---|
| Kобальт (Co) | α-Co | Ниже 422 | Гексагональная плотноупакованная (ГПУ) |
| β-Co | 422 … 1495 | Гранецентрированная кубическая (ГЦК) | |
| Марганец (Mn) | α-Mn | Ниже 727 | Kубическая сложная |
| β-Mn | 727 … 1095 | Kубическая сложная | |
| γ-Mn | 1095 … 1134 | Гранецентрированная кубическая (ГЦК) | |
| δ-Mn | 1134 … 1246 (плавление) | Объемно-центрированная кубическая (ОЦК) | |
| Титан (Ti) | α-Ti | Ниже 882 | Гексагональная плотноупакованная (ГПУ) |
| β-Ti | 882 … 1668 (плавление) | Объемно-центрированная кубическая (ОЦК) |
Важно отметить, что большинство цветных металлов, включая алюминий, медь, цинк и магний, не обладают свойством аллотропии, их кристаллическая структура остается неизменной вплоть до точки плавления.
Заключение
Металлы — это не просто однородные материалы, а сложные иерархические системы, свойства которых закладываются на уровне атомной структуры. Взаимосвязь между типом кристаллической решетки, размером зерна и макроскопическими характеристиками, такими как прочность, пластичность и твердость, является фундаментом современного материаловедения. Знание процессов кристаллизации, деформации и аллотропических превращений позволяет инженерам целенаправленно управлять свойствами металлов и сплавов через легирование, термическую и механическую обработку, создавая материалы для самых ответственных и высокотехнологичных применений. Развитие новых методов исследования и технологий, таких как аддитивное производство (3D-печать металлами), открывает новые горизонты в конструировании материалов с заранее заданными, уникальными свойствами, продолжая великую историю металлов в развитии человечества.
