Содержание страницы
1. Кристаллическое строение материалов
В природе существуют две разновидности твёрдых тел, различающиеся по своим свойствам: кристаллические и аморфные (рис.1).
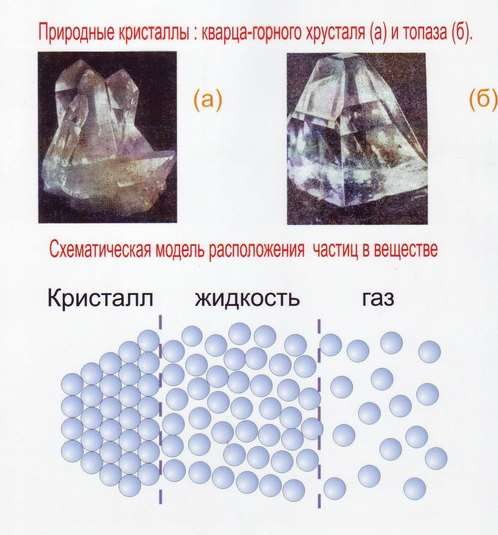
Рис. 1 Кристаллическое строение вещества
При охлаждении аморфных тел нет явной температуры перехода из жидкого состояния в твёрдое, в то время как кристаллические тела имеют конкретную температуру кристаллизации (рис.2).
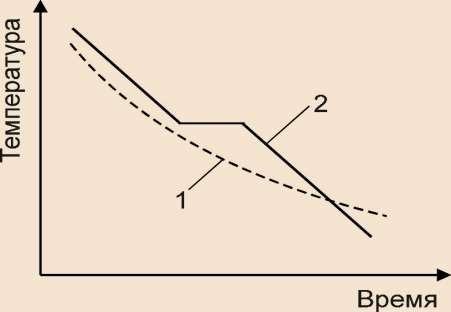
Рис. 1. 2 Кривые охлаждения: 1- аморфных тел; 2 – кристаллических
Аморфные тела при нагреве размягчатся в большом температурном интервале, становятся вязкими, а затем переходят в жидкое состояние.
Кристаллические тела остаются твёрдыми, т.е. сохраняют приданную им форму, до вполне определенной температуры, при которой они переходят в жидкое состояние. Кристаллические тела характеризуются упорядоченным расположением в пространстве элементарных частиц (ионов, атомов, молекул), из которых они составлены – геометрический фактор (рис.3)
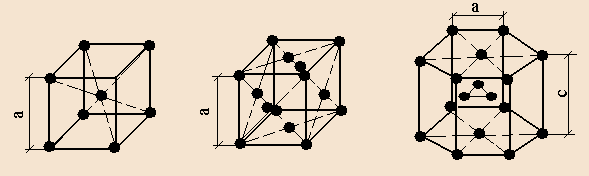
Рис.3 Кристаллические решётки
Свойства кристаллов зависят:
- от электронного строения атомов.
- характера взаимодействия их в кристалле.
- от пространственного расположения элементарных частиц.
- химического состава.
- размера и формы кристаллов.
В зависимости от размеров структурных составляющих и применяемых методов их выявления используют следующие понятия:
- тонкая структура. (х 20000 – 150000)
- микроструктура. (до х1500) рис.4, а
- макроструктура. (до х10) рис.4, б


а б
Рис.4 Микроструктура (а) и макроструктура (б) сплава
Кристаллическая решётка. В кристалле элементарные частицы (ионы, атомы, молекулы), из которых построен кристалл, сближены до соприкосновения и располагаются различно, но закономерно по разным направлениям. Наименьший параллелепипед, в котором в узлах находятся элементарные частицы, называют элементарной ячейкой. Последовательное перемещение его образует пространственную кристаллическую решётку.
Для описания элементарной ячейки кристаллической решётки используют шесть величин: три отрезка – период решётки a, b, c, три угла между этими отрезками α, β, γ (рис.5)
Соотношения между этими величинами определяют форму ячейки. По форме элементарных ячеек все кристаллы подразделяют на семь систем (рис.6)
В большинстве случаев решётки сложны, так как элементарные частицы находятся не только в узлах кристаллической решётки, но и на её гранях или в центре решётки (рис.7, 8, 9)
О степени сложности судят по числу частиц, приходящихся на одну элементарную ячейку. В простой пространственной решётке всегда на одну ячейку приходится одна частица. На ОЦК ячейку – две частицы. На ГЦК ячейку – четыре частицы.
Система, период, число частиц, приходящихся на элементарную ячейку, полностью определяют расположение элементарных частиц в кристалле.

Рис.5 Пространственно-кристаллическая решётка
Кристаллические системы элементов
| Система | Период | Углы |
| Триклинная | a ≠ b ≠ c | α ≠ β ≠ γ |
| Моноклинная | a ≠ b ≠ c | α = β = 90о γ ≠ 90о |
| Ромбическая | a ≠ b ≠ c | α = β = γ =90о |
| Ромбоэдрическая | a = b = c | α = β = γ ≠ 90о |
| Гексагональная | a = b ≠ c | α = β = 90о γ = 120о |
| Тетрагональная | a = b ≠ c | α = β = γ =90о |
| Кубическая | a = b = c | α = β = γ =90о |
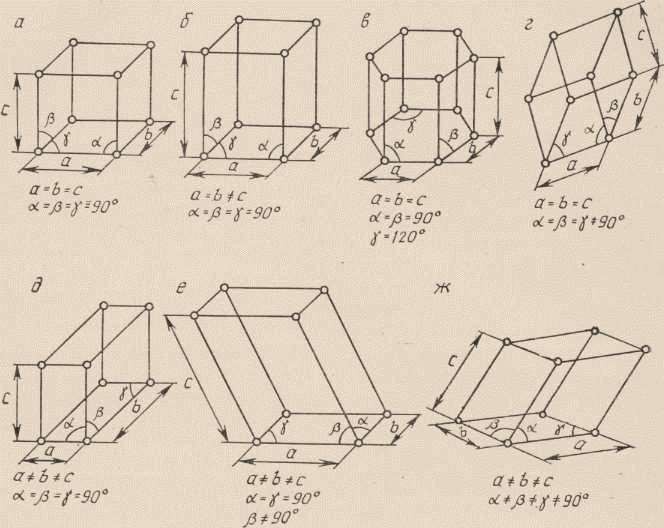
Рис.6 Семь систем элементарных ячеек
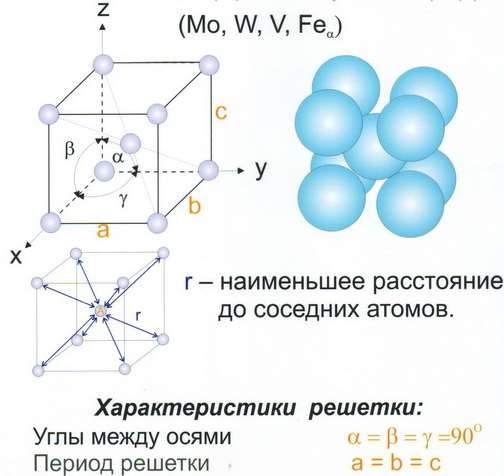
Рис 7 Решётка объёмноцентрированная кубическая (ОЦК)
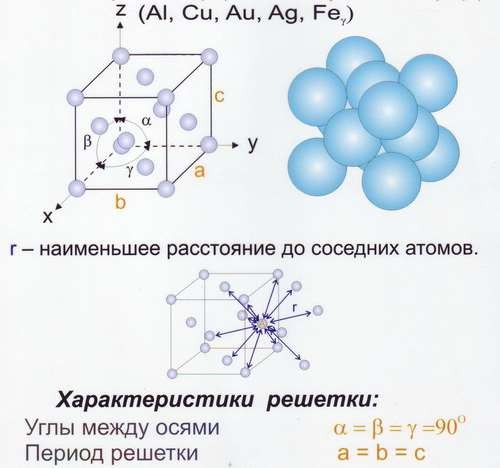
Рис.8 Решётка гранецентрированная кубическая (ГЦК)
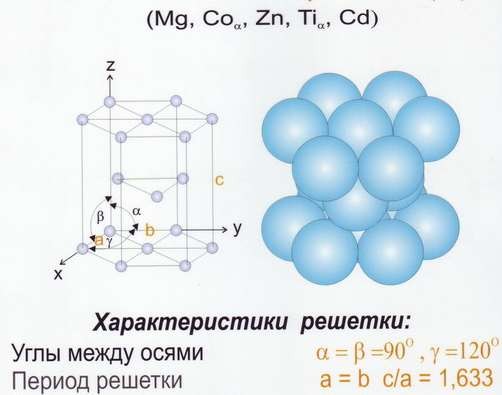
Рис.9 Решётка гексогональная плотноупакованная (ГПУ)
Дополнительные характеристики: координационное число и коэффициент компактности.
Координационное число – число ближайших и равноудалённых элементарных частиц. (К). Для ОЦК – К8. Для ГЦК – К12. Для простой кубической решётки – К6.
Коэффициент компактности – отношение объёма всех элементарных частиц, приходящихся на одну элементарную ячейку, ко всему объёму элементарной ячейки.
Для простой кубической решётки – 0,52. Для ОЦК – 0,68. Для ГЦК – 0,74.
Оставшееся пространство образуют поры, которые дифференцируют на октаэдрические (восьмигранник) и тетраэдрические (четырёхгранник).
Кристаллографические индексы.
По параллельным направлениям свойства одинаковы, поэтому достаточно указать для всего семейства параллельных прямых одно направление, проходящее через начало координат (узел кристаллической решётки). Координаты этого узла выражают целыми числами u, v, w в единицах отрезков a, b, c, заключают в квадратные скобки [u, v, w] и называют индексами направлений. Их всегда выражают целыми числами, а отрицательное значение обозначается знаком минусом над индексом.
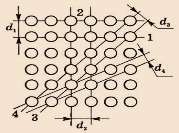
Положение плоскости в пространстве определяется отрезками, отсекаемыми плоскостью по осям x, y, z. Эти отрезки выражают целыми числами m, n, p в единицах отрезков a, b, c. Принято за индексы плоскостей брать обратные отрезки: h = 1/m; k = 1/n; l = 1/p. Три этих числа (h, k, l) заключённые в круглые скобки, называют индексами плоскостей. Если плоскость отсекает по осям отрицательные отрезки, то это отмечается знаком минус над соответствующим индексом (рис. 10).
Анизотропия.
(греч. Anises неравный + tropes свойства)
Это зависимость свойств кристалла от направления, возникающая в результате упорядоченного расположения атомов (ионов, молекул) в пространстве. В кристалле расстояния между атомами в различных кристаллографических направлениях различны, а поэтому различны и свойства. Прочность и пластичность монокристалла изменяется в зависимости от направления. В природных условиях кристаллические тела – поликристаллы, т.е. состоят из множества мелких различно ориентированных кристаллов. В связи с этим поликристаллические тела считают мнимо изотропными. В процессе обработки давлением поликристалла кристаллографические плоскости одного индекса в различных зёрнах могут ориентироваться параллельно. Такие поликристаллы называют текстурованными, и они, подобно монокристаллам, анизотропные (рис.11).
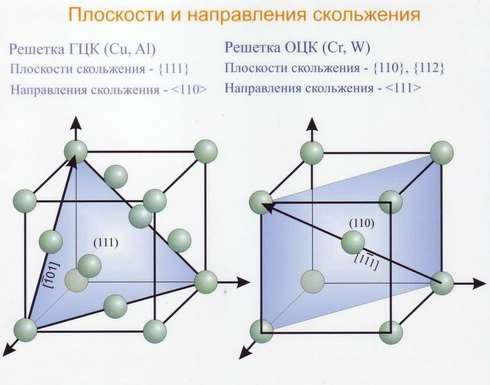
Рис.10 Кристаллографические индексы

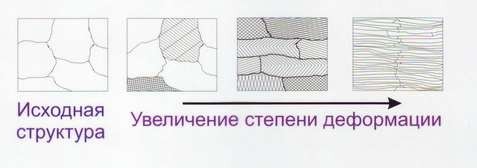
Рис. 11 Изменение структуры при пластической деформации
Влияния типа связи на структуру и свойства кристаллов.
Тип связи, возникающий между элементарными частицами в кристалле, определяется электронным строением атомов, вступающих во взаимодействие. Элементарные частицы в кристалле сближаются на определённое расстояние, которое определяется взаимодействием сил, действующих в кристалле. Силы притяжения возникают благодаря взаимодействию электронов с положительно заряженным ядром собственного атома, а также с положительно заряженными ядрами соседних атомов. Силы отталкивания возникают в результате взаимодействия положительно заряженных ядер соседних атомов при их сближении. Они проявляются при сильном сближении и растут интенсивнее, чем силы притяжения.
Уравновешивание сил происходит при сближении атомов на расстояние dо. Этому сближению соответствует максимум энергии связи Есв, что делает кристалл термодинамически стабильным (рис.12).
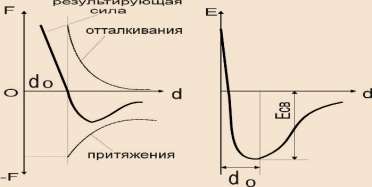
Рис.12 Результирующая сила и энергия связи в кристаллах
Есв определяет: температуру плавления, испарения, модуль упругости, температурный коэффициент линейного расширения.
Все кристаллы по характеру превалирующей связи подразделяют:
- молекулярные;
- ковалентные;
- металлические;
- ионные.
Молекулярные кристаллы.
В кристаллах инертных газов связь Ван-дер-Ваальса единственная, а, следовательно, она определяет структуру и свойства кристаллов.
Ковалентные кристаллы.
Ковалентная связь характеризуется направленностью, так как каждый атом вступает в обменное взаимодействие с определённым числом соседних атомов.
Вследствие большой энергии связи ковалентные кристаллы характеризуются высокими температурами плавления и испарения.
Металлические кристаллы.
В металлическом кристалле при взаимодействии с элементами других групп атомы легко отдают свои валентные электроны и превращаются в положительные ионы. Металлическая связь ненаправленная, так как каждый атом стремиться притянуть к себе как можно больше соседних атомов.
Среди металлов и некоторых неметаллов распространено явление полиморфизма – способность в твёрдом состоянии при различных температурах (или давлении) иметь различные типы кристаллических структур ОЦК, ГЦК, ГПУ и т. Эти кристаллические структуры называют аллотропическими формами или модификациями. Низкотемпературную модификацию называют α, а высокотемпературные β, γ, δ и т.д.
Стабильность модификаций при определённой температуре и давлении определяется значением термодинамического потенциала (свободной энергией G).
G = H – ST
Более стабильной при данной температуре будет модификация, имеющая меньшее алгебраическое значение термодинамического потенциала, что может быть достигнуто либо за счёт малой энтальпии H, либо большой энтропии S.
Энтальпия H – (греч. enthalpy нагреваю) физическая функция независимых переменных – давления и энтропии, однозначно определяющая состояние фаз. Системы в термодинамике (термодинамический потенциал).
Энтропия S (греч. еp в, внутрь + trope поворот, превращение) мера внутренней неупорядоченности системы.
Температурным полиморфизмом обладают около тридцати металлов. Быстрое охлаждение может сохранить высокотемпературную модификацию в течение длительного времени при Т = 20-25оС, так как низкая диффузионная подвижность атомов при таких температурах не способна вызвать перестройку решётки. Кроме того, известен полиморфизм под влиянием температуры и давления (графит – алмаз).
Ионные кристаллы.
В сложных кристаллах, состоящих из элементов различной валентности, возможно образование ионного типа связи. Представитель этой группы – кристалл оксида FeO, решётка которого состоит из отрицательно заряженных ионов кислорода и положительно заряженных ионов железа. Перераспределение валентных электронов при ионной связи происходит между атомами одной молекулы (одним атомом железа и одним атомом кислорода).
Дефекты кристаллов.
Строение реальных кристаллов отличается от идеальных. В реальных кристаллах всегда содержатся дефекты, а потому нет идеально правильного расположения атомов во всём объёме кристалла.
Дефекты кристаллов подразделяют:
- точечные;
- линейные;
- поверхностные;
Точечные дефекты. К ним относятся: вакансии, межузельные атомы основного вещества, чужеродные атомы внедрения (рис.13).
Вакансии – являются самой важной разновидностью точечных дефектов; они ускоряют все процессы, связанные с перемещением атомов: диффузия, спекание порошков и т.д. В технически чистых металлах точечные дефекты повышают электросопротивление, а на механические свойства почти не влияют.
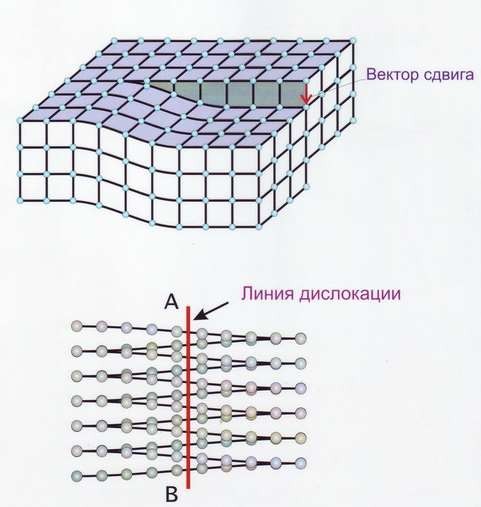
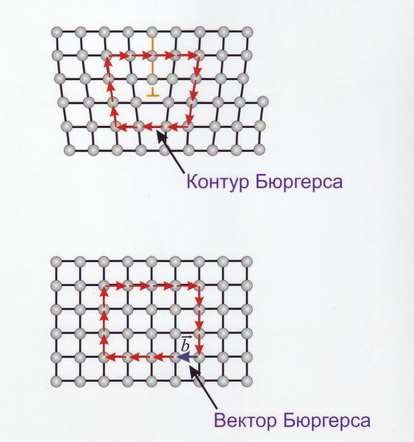
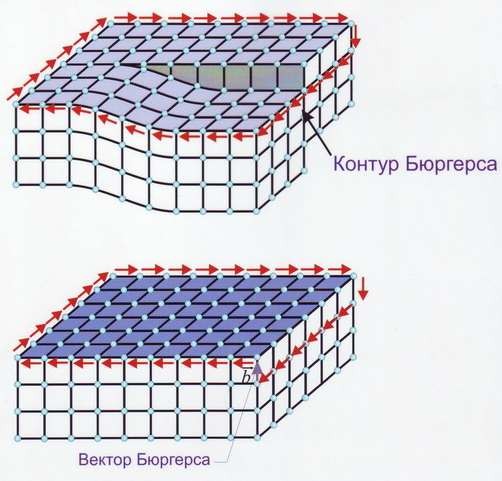
Линейные дефекты – краевые и винтовые дислокации (рис.14). Краевая дислокация в сечении представляет собой край «лишней» полуплоскости в решётке. Вокруг дислокаций решётка упруго искажена. Мерой искажения служит так называемый вектор Бюргерса (рис.15). У краевой дислокации вектор Бюргерса равен межатомному расстоянию и перпендикулярен дислокационной линии, у винтовой дислокации – параллелен ей.
На рис. 16 показана схема движения дислокаций под действием тангенциальных напряжений (τ).
На рис.17 показана зависимость сопротивление деформации металлов, определяемое значениями Ϭв, Ϭт от плотности дислокаций (ρ), которая определяется как суммарная их длина, см, в 1 см3, т.е. выражается в см-2. Теоретически рассчитанная прочность идеального кристалла в 103 раз выше экспериментально определённых значений для реального кристалла. К теоретической прочности приближается прочность практически бездефектных кристаллов – нитевидные кристаллы («усы»). К настоящему времени удалость получить кристаллы, практически не содержащие дислокаций. Эти нитевидные кристаллы небольших размеров (длиной 2 – 10 мм и толщиной 0,5 – 2,0 мкм), обладают прочностью, близкой к теоретической. Так, нитевидные кристаллы железа имеют предел прочности Ϭв = 13000 Мпа, а техническое железо – только 300 Мпа. Наименьшими значением прочности обладают чистые и отожжённые металлы (плотность дислокаций 106 – 108 см-2).
Расчёт учёных показал, что наиболее высшая прочность, которой можно достичь увеличением количества дефектов в металле, около 1010 – 1012 см2 Это объясняют тем, что дислокации начинают препятствовать деформационным смещениям друг другу (образования дислокационных сеток).
Если количество дислокаций превышает 1012 – 1013, то прочность металла резко падает из-за разрушения кристаллов в местах большого скопления дефектов.

Рис.13 Вакансия и межузельный атом
В настоящее время много способов повышения прочности изделий (легирование, обработка металлов давлением, термическая обработка и т.д.), но до сих пор мы не можем точно сказать, что такое прочность. На этот вопрос, однако, не может быть однозначного ответа. С одной стороны, прочность – сопротивление пластической деформации; с другой, сопротивление хрупкому разрушению; с третьей, сопротивление износу; с четвёртой, стойкость против коррозии; с пятой, способность выдерживать высокие температуры под нагрузкой и т. д.
В зависимости от того, в каких условиях должна работать та или иная деталь, важнее оказываются те или иные приданные ей качества. Вот почему, говоря дальше о прочности металлических изделий, мы каждый раз будем иметь в виду не какую-то абстрактную прочность, а вполне конкретную способность металлического изделия сопротивляться определённым внешним воздействиям.
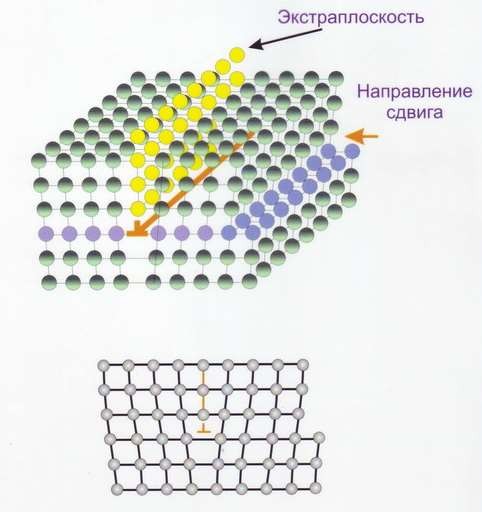
а
б
Рис.14 Краевая дислокация (а) и винтовая дислокация (б)
а
б
Рис.15 Контур и вектор Бюргерса у краевой (а) и винтовой (б) дислокации
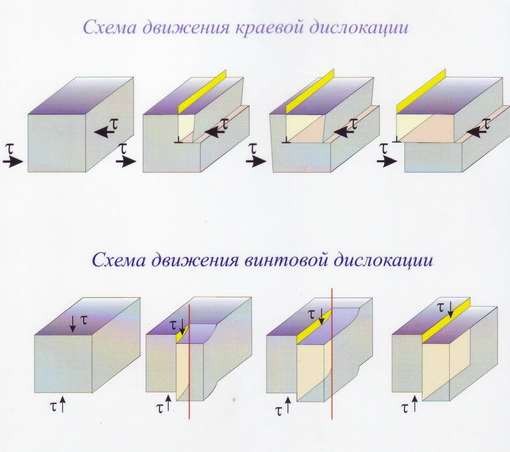
Рис.16 Схемы движения дислокаций
Поверхностные дефекты. Наиболее важными поверхностными дефектами являются больше угловые и мало угловые границы, дефекты упаковки, границы двойников (рис.18, 19).
Границы между зёрнами называются больше угловыми, так как соответственные кристаллографические направления в соседних зёрнах образуют углы в десятки градусов. Каждое зерно, в свою очередь, состоит из субзёрен и блоков.
Субзерно представляет собой часть кристалла относительно правильного строения. Границы субзёрн представляют собой стенки дислокаций, которые разделяют зерно на отдельные субзёрна и блоки. Угол взаимной разориентации между соседними субзёрнами невелик (не более 5о), поэтому такие границы называются мало угловыми. На мало угловых границах также скапливаются примеси.
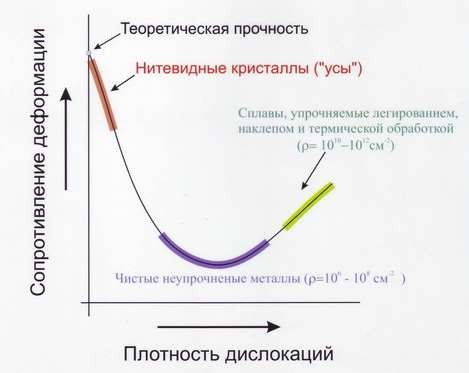
Рис.17 Зависимость сопротивление деформации от числа дефектов
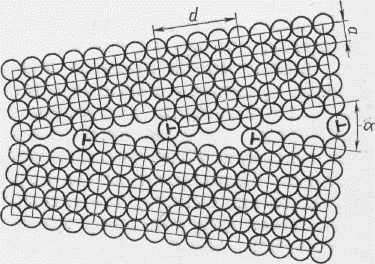
Рис.18 Граница субзерна
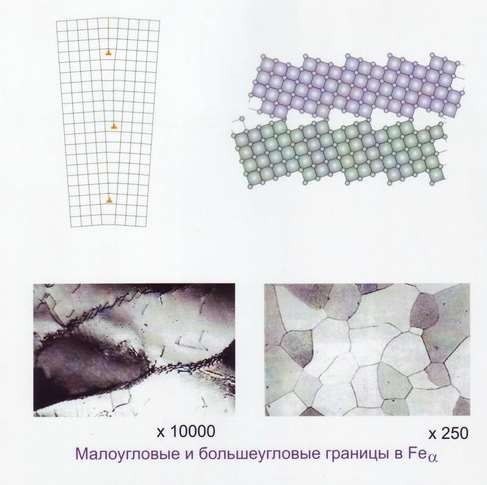
Рис.19 Границы зёрен и субзёрен
Дефект упаковки представляет собой часть атомной плоскости, ограниченную дислокациями, в пределах которой нарушен нормальный порядок чередования атомных слоёв рис.20.
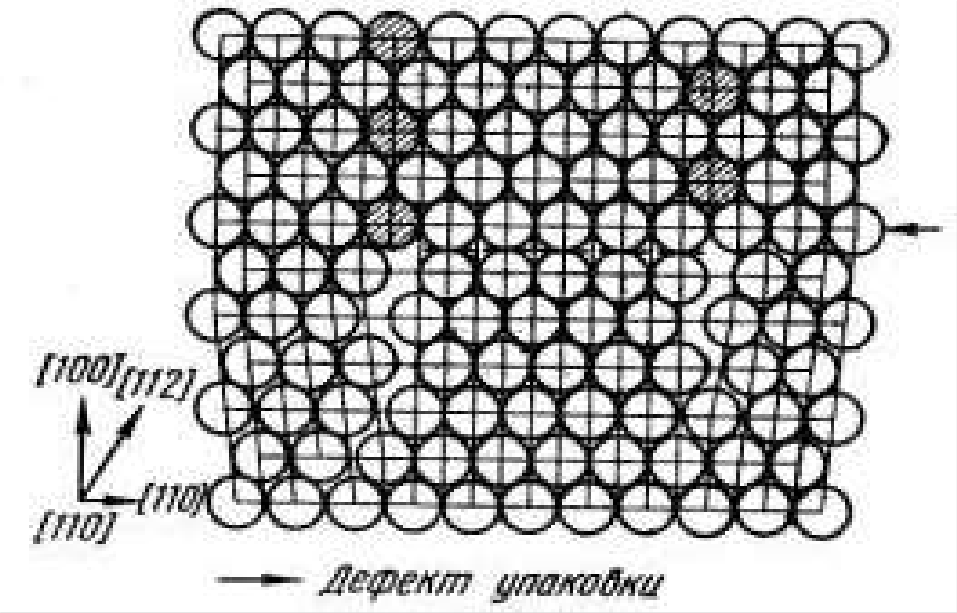
Рис.20 Дефект упаковки
Границы двойников представляют образование в монокристалле областей с закономерно измененной ориентацией кристаллической структуры. Структуры двойниковых образований являются либо зеркальным отражением атомной структуры материнского кристалла (матрицы) в определенной плоскости, либо образуются поворотом структуры матрицы вокруг кристаллографической оси на некоторый угол, постоянный для данного вещества, либо другими преобразованиями симметрии. Пара — матрица и двойниковое образование — называется двойником рис.21.
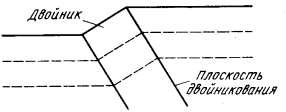

Рис.21 Граница двойников
Выводы.
Поверхностные дефекты влияют на механические и физические свойства материалов. Особенно больше значение имеют границы зёрен. Предел текучести σt связан с размером зёрен d зависимостью σt = σо + k d-1/2, где σо и k – постоянные для данного материала. Чем мельче зерно, тем выше предел текучести, вязкость и меньше опасность хрупкого разрушения. Аналогично, но более слабо влияет на механические свойства размер субзёрен.
Размер зерна определяется по ГОСТу (рис.22).
Фазовый состав сплавов.
В сплавах элементы могут различно взаимодействовать между собой, образуя различные по химическому составу, типу связи и строению кристаллических фаз. Эти кристаллы в зависимости от атомно-кристаллической структуры принято делить на два основных вида:
- твёрдые растворы;
- промежуточные фазы
Твёрдыми растворами называют кристаллы, в которых сохраняется кристаллическая решётка одного элемента растворителя.

Рис.22 Шкала размеров зерна, X 100 (ГОСТ 5639-82)
Такие растворы являются кристаллическими фазами переменного состава. Они могут быть неограниченной растворимости для твёрдых растворов замещения и ограниченной растворимости для твёрдых растворов замещения и внедрения.
Твёрдые растворы замещения (рис.23).
Твёрдые растворы внедрения (рис.24). Такие твёрдые растворы возникают при сплавлении переходных металлов с неметаллами, имеющими малый атомный радиус – Н, N, С, В.
Твёрдые растворы внедрения всегда имеют ограниченную растворимость и встречаются преимущественно тогда, когда растворитель имеет ГПУ или ГЦК решётки.
Заключение: твёрдые растворы составляют основу большинства промышленных конструкционных сплавов и сплавов специального назначения. Они отличаются хорошей технологической пластичностью: хорошо деформируются в горячем состоянии, а многие и в холодном состоянии.
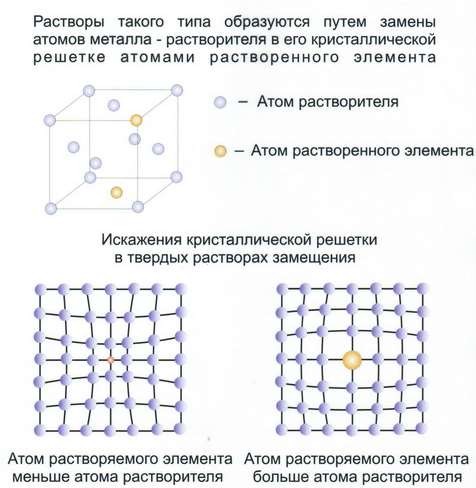
Рис.23 Твёрдые растворы замещения
Промежуточные фазы.
Промежуточной фазой называют – кристаллы, образованные различными элементами и имеющие собственный тип кристаллической решётки, отличающийся от решёток составляющих их элементов.
Промежуточные фазы обозначают так же, как и твёрдые растворы, буквами греческого алфавита.
К этим фазам относят и химические соединения (рис.25). Они имеют следующие особенности:
- состав, который может быть выражен простой формулой АnBm, где А и В – соответствующие элементы, а n и m – целые числа;
- кристаллическую решётку, отличную от кристаллических решёток элементов, образующих соединения;
- свойства, резко отличающихся от свойств образующих соединения элементов;
- постоянную температуру кристаллизации, как и у чистых металлов.
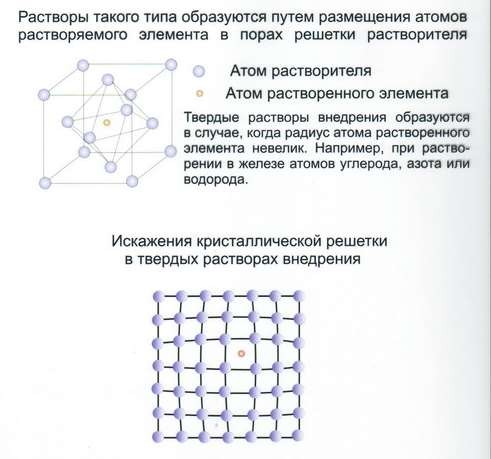
Рис.24 Твёрдые растворы внедрения
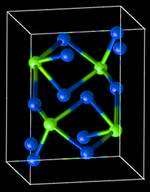
Рис.25 Кристал лическая решётка цементита (карбид железа)
Диффузия в металлах и сплавах.
Диффузия – перенос разнородных атомов, который сопровождается изменением концентрации компонентов в отдельных зонах сплава.
Самодиффузии – переход атомов металла из узла кристаллической решётки в соседний или межузлие под действием теплового возбуждения.
Механизмы диффузии (самодиффузии) (рис.26)
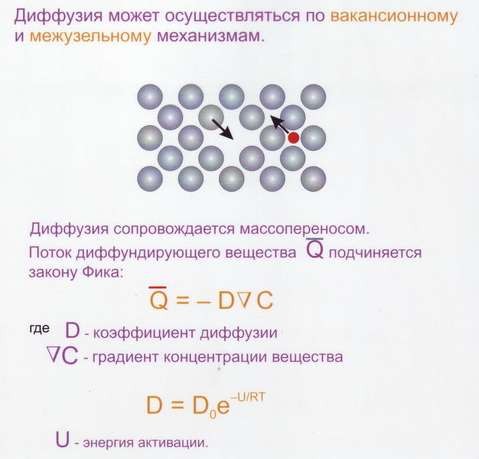
Рис.26 Диффузия в металлах
Жидкие кристаллы
Жидкие кристаллы – это жидкости с упорядоченной молекулярной структурой (в основном органические вещества, у которых молекулы имеют удлинённую форму).
Жидкие кристаллы текучи, как обычные жидкости, но в то же время обладают анизотропией свойств, как кристаллы (рис.27)
При переходе из-за усилившихся тепловых колебаний упорядоченная молекулярная структура полностью исчезает, увеличивается прозрачность вещества, и поэтому верхнюю температурную точку существования жидкого кристалла часто называют точкой просветления.
По структуре жидкие кристаллы разделяют на три класса:
- нематические – молекулы выстроены в цепочки;
- смектические – молекулы образуют параллельные слои;
- холестерические – молекулы размещаются по пространственной спирали.
На основе жидких кристаллов изготовляют медицинские термометры для контроля перегрева узлов и деталей, преобразователи невидимого инфракрасного излучения в видимый свет. В последнем случае поглощение инфракрасного излучения нагревает жидкий кристалл так, что изменяется окраска отражённого света. Жидкие кристаллы применяют в модуляторах, системах отображения информации – калькуляторах, ручных часах, измерительных приборах автомобилей, устройствах для отклонения светового потока и др.

 Холестерическая фаза
Холестерическая фаза
Рис.27 Текстуры жидких кристаллов
Структура полимеров, стекла и керамики.
Полимерами – называют вещества с большой молекулярной массой, у которых молекулы состоят из одинаковых групп атомов – звеньев (мономера) (рис.28, 29). В зависимости от характера связей между линейными молекулами полимеры разделяют:
- термопластичные;
- термореактивные.
Термопластичные полимеры, способны многократно размягчатся при нагреве, и твердеть при охлаждении без изменения своих свойств.
Термореактивны е полимеры при нагреве остаются твёрдыми вплоть до полного термического разложения.
Полимеры по структуре макромолекулы.
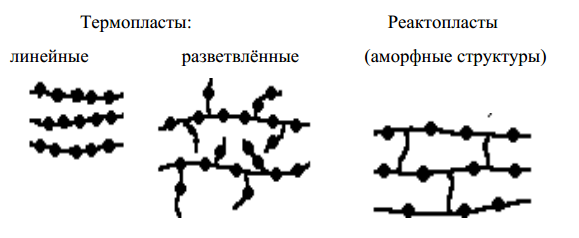
Рис.28 Структура полимеров
Керамикой называют материалы, полученные при высокотемпературном спекании минеральных порошков (рис.30). Характерной особенностью керамических материалов является хрупкость.
Ситаллы или стеклокристаллические материалы получают из стёкол специального состава при помощи контролируемой кристаллизации.
Фотоситаллы применяют как фоточувствительные материалы.
Термоситаллы имеют универсальное применение: как износостойкие материалы используются для деталей гидромашин, узлов трения, защитных эмалей; как прочные стабильные диэлектрики для радиодеталей, плат и т.п. (рис.31).
Стекло представляет собой аморфное вещество, образующееся при сплавлении оксидов или без оксидных соединений. Основу стекла образует объёмная сетка из однородных структурных элементов. Структура аморфного стекла возникает при охлаждении стеклянной массы, когда повышение её вязкости препятствует кристаллизации (рис.32).
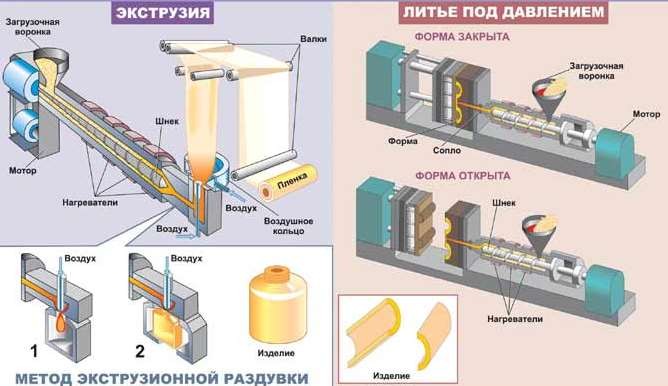
Рис.29 Получение изделий из термопластичных полимеров

Рис.30 Детали из керамики

Рис.31 Детали из стеклокристаллических материалов

Рис.32 Мебель из стекла
2. Кристаллизация сплавов
Переход металла из жидкого состояния в твёрдое с образованием кристаллической структуры называется первичной кристаллизацией.
Образования новых кристаллов в твёрдом кристаллическом веществе называется вторичной кристаллизацией (перекристаллизацией).
Процесс кристаллизации состоит из двух одновременных процессов:
- зарождение кристаллов;
- линейный рост кристаллов;
Кристаллы могут зарождаться самопроизвольно (самопроизвольная кристаллизация) или зарождаться и расти на имеющихся готовых центрах кристаллизации (не самопроизвольная кристаллизация) (рис 33).
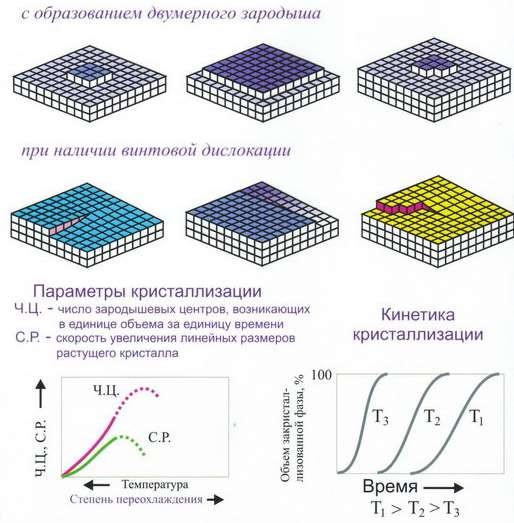
Рис 34 Рост зародышевых центров и рост кристаллов
Самопроизвольная кристаллизация (рис.35) обусловлена стремлением вещества иметь более устойчивое состояние, характеризуемое уменьшением термодинамического потенциала G, характеристика свободной энергии системы. Второй закон термодинамики – любая система всегда стремится занять то состояние, чтобы она обладала min свободной энергией. Температура, при которой термодинамические потенциалы вещества, как в твёрдом, так и в жидком состояниях равны, называется равновесной температурой (термодинамической температурой) ТG.
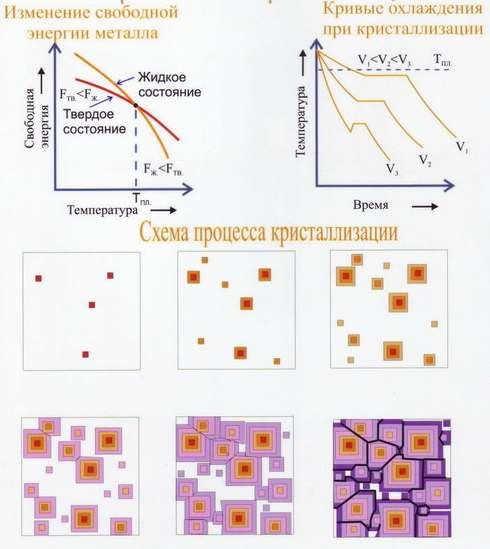
Рис.35 Самопроизвольная кристаллизация
Термодинамический потенциал определяется:
G = Е – ТS + РV (по Гельмгольцу)
где G – термодинамический потенциал, свободная энергия системы,
Е – внутренняя энергия системы,
Т – термодинамическая температура
S – энтропия (функция состояния: порядка и беспорядка, связанное с поступательным и колебательным движением),
РV – работа внешних сил (давление на объём)
G = Н – ТS (по Гиббсу)
где Н – энтальпия (Е + РV) сумма работ внутренних и внешних сил.
Разница между равновесной (ТG.) и реальной (Тр) температурой кристаллизации называется степенью переохлаждения (Δ Т).
Образованию зародышей способствуют флуктуации энергии, т.е. отклонение энергии группировок атомов в отдельных зонах жидкого металла от некоторого среднего значения.
Появление зародышей изменяет термодинамический потенциал (свободную энергию) всей системы. С одной стороны, при переходе жидкости в кристаллическое состояние термодинамический потенциал G уменьшается, с другой стороны, он увеличивается (+) вследствие появления поверхности раздела между жидкостью и кристаллическим зародышем.
На рис.36 показано, как изменяется свободная энергия системы при кристаллизации.
Кинетика кристаллизации. Скорость образования зародышей, образующихся в единицу времени в единице объёма (1мм-3с-1); скорость роста – увеличением линейных размеров, растущих кристалла в единицу времени (мм/с). Оба процесса связаны с перемещением атомов и зависят от температуры (степени переохлаждения Δ Т).
Не самопроизвольная кристаллизация (гетерогенная)
В реальных условиях процессы кристаллизации и характер образующих структур в значительной мере зависят от имеющихся готовых центров кристаллизации. Такими центрами являются:
- тугоплавкие частицы неметаллических включений;
- оксиды;
- интерметаллические соединения, образуемых примесей.
Измельчение структуры способствует улучшению механических свойств металла.

Рис.36 Изменение свободной энергии при кристаллизации
На практике для измельчения структуры металла и сплавов широко применяют технологическую операцию, называемую модифицированием. Она состоит во введении в жидкий сплав перед заливкой специальных добавок модификаторов (бор в сталь, натрий в алюминий и его сплавы). Подстуживание металла перед заливкой до температур, незначительно превышающих температуру плавления металла, способствует уменьшению размера зерна.
Формирование кристаллов
Форма и размер зёрен, образующихся при кристаллизации, зависят:
- скорости и направления отвода тепла:
- температуры жидкого металла;
- содержание примесей.
Структура слитка зависит от многих факторов: (рис.37)
- количество и свойства примесей в чистом металле;
- количества легирующих элементов в сплаве;
- температуры разливки сплава;
- скорость охлаждения при кристаллизации и т.д.

Рис.37 Схема строения металлического слитка, полученного при разных температурах
Типичная структура слитка сплавов состоит из трёх зон: (рис.38)
- мелкие равноосные кристаллы на поверхности слитка, из-за большой степени переохлаждения;
- столбчатые кристаллы, наиболее благоприятно ориентированные по отношению к теплоотводу, расположенные нормально к стенкам формы;
- равноосные кристаллы больших размеров в середине слитка, где наблюдается наименьшая степень переохлаждения и не ощущается направленного отвода тепла.
Структура, состоящая из одних столбчатых кристаллов, называется транскристаллитной. Встречается у слитков очень чистых металлов.
Химическая неоднородность по отдельным зонам слитка называется зональной ликвацией. Она отрицательно влияет на механические свойства сплава. В реальных сплавах кроме зональной встречаются и другие виды ликвации.
Аморфное состояние металлов
При сверхвысоких скоростях охлаждения (106 оС/с) из жидкого состояния диффузионные процессы настолько замедляются, что подавляется образование зародышей и рост кристаллов. В этом случаи при затвердевании об
разуется аморфная структура (аморфные сплавы или металлические стёкла) (рис.39).
Аморфные металлические материалы удачно сочетают высокие прочность, твёрдость и износостойкость с хорошей пластичностью и коррозионной стойкостью.
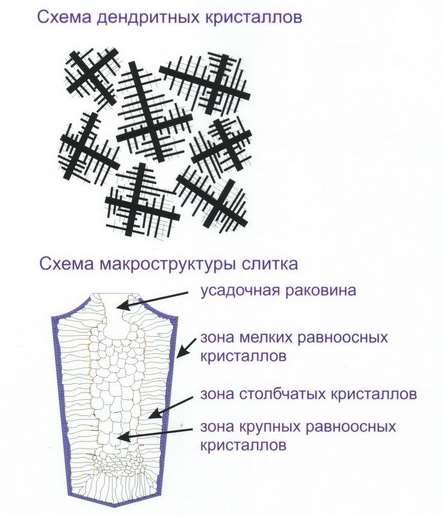
Рис.38 Строение слитка
Большое практическое значение имеет также и возможность получения аморфных металлов в виде лент, проволоки диаметром несколько микрометров непосредственно при литье, минуя такие дорогостоящие операции, как ковка, прокатка, волочение, промежуточные отжиги, зачистки, травление.
В настоящее время аморфная структура получена более чем у 20 чистых металлов и полупроводниковых материалов и более 110 сплавов. Это сплавы легкоплавких, редкоземельных и переходных металлов.
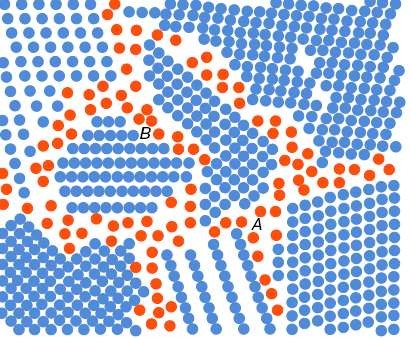
Рис. 39 Структура аморфного металлического сплава
А – межкристаллитная компонента, образуемая из всех атомов, расположенных по границам зёрен;
В – структурная компонента кристаллическая, которая включает себя атомы, расположенные внутри кристалла

