Ключевыми понятиями термодинамики являются параметры состояния: температура, давление, плотность, удельный объем, энтальпия, энтропия и теплоемкость. Они отражают внутреннее состояние вещества или системы и позволяют строить уравнения, описывающие процессы теплообмена и превращения энергии. Для этих параметров характерна уникальная особенность — их значения определяются только начальным и конечным состоянием системы, а не способом перехода между ними.
Точная регистрация и измерение термодинамических величин требует применения соответствующих приборов: манометров, термометров, вакуумметров и датчиков. Измерительные системы развивались вместе с наукой, становясь всё более точными, устойчивыми и универсальными.
Термодинамика возникла как самостоятельная научная дисциплина в XVII–XIX веках на фоне технической революции и развития паровых машин. Одним из первых прорывов стало открытие закона Бойля-Мариотта (1662), описывающего связь между давлением и объемом газа при постоянной температуре. Позднее Жан-Батист Жозеф Фурье, Сади Карно и Рудольф Клаузиус заложили основы термодинамических законов, введя понятия энергии, работы, энтропии и внутренней энергии.
Параллельно с развитием теории эволюционировали измерительные приборы. Галилео Галилей в 1593 году создал прообраз термометра. Бурдон в XIX веке разработал первый манометр с упругой трубкой, применяемый до сих пор.
Шкалы измерения температуры, такие как Цельсия, Фаренгейта и Кельвина, формировались по мере необходимости стандартизации научных и инженерных расчетов. Особенно важным стал абсолютный масштаб Кельвина, основанный на представлении о нулевой точке теплового движения.
Параметры состояния — это величины, описывающие текущее состояние вещества или системы, изменяющиеся при переходе из одного состояния в другое, но не зависящие от конкретного механизма этого перехода. При классификации этих параметров принято разделять их на интенсивные и экстенсивные.
Интенсивные параметры характеризуются тем, что не зависят от массы или объема системы. К ним можно отнести такие параметры, как температура и давление. Эти параметры остаются неизменными при делении системы на части.
Экстенсивные параметры, также называемые аддитивными, изменяются пропорционально изменению массы или размера системы. Примерами таких величин являются объем, внутренняя энергия, энтропия, теплосодержание.
К числу основных показателей состояния термодинамической системы относят температуру (T), давление (p), плотность (ρ), удельный объем (v), удельную энтальпию (h), удельную энтропию (s), а также удельную теплоемкость (c).
Температура представляет собой физическую характеристику, которая отражает уровень внутренней энергии системы и воспринимается как степень нагретости тела или среды.
На практике температура чаще всего выражается в градусах Цельсия (°C), что основывается на температурных точках изменения состояния воды при стандартных условиях. В расчетах термодинамического характера предпочтительно применять температуру в Кельвинах (К), то есть абсолютную шкалу, как показано на рисунке 5.
Для пересчета температурных значений из одной шкалы в другую используют специальные формулы, в частности, для преобразования температуры Цельсия в Кельвины:
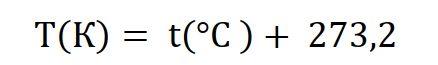 (1)
(1)
Кроме этих шкал, в некоторых странах используется температура в градусах Фаренгейта (°F), что важно учитывать при эксплуатации зарубежного оборудования. Перевод значений из шкалы Фаренгейта в Цельсий осуществляется следующим соотношением:
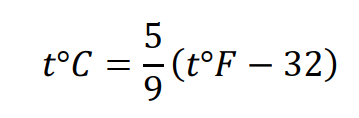 (2)
(2)
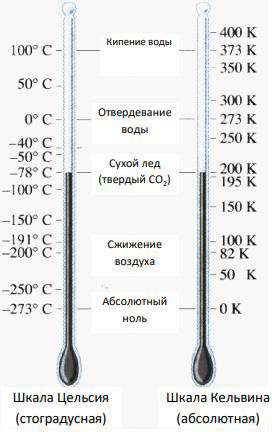
Рисунок 5 – Температурные шкалы Кельвина и Цельсия
Для измерения температуры применяют различные типы термометров, каждый из которых находит применение в определенных условиях. К основным видам относятся электронные (например, термопары, термосопротивления), а также инфракрасные, жидкостные, механические и другие (рис. 6). Их выбор зависит от точности, диапазона измерения и условий эксплуатации.

Рисунок 6 – Термометры: а) электрический; б) инфракрасные; в) манометрический
Давление определяется как величина, равная отношению силы, действующей перпендикулярно к поверхности, к площади этой поверхности. В международной системе СИ оно измеряется в паскалях (Па), где 1 Па = 1 Н/м2. Для выражения больших значений давления чаще используют бары или атмосферы: 1 бар = 105 Па.
Техническая атмосфера (ат) является внесистемной единицей измерения давления и соответствует давлению, создаваемому силой в 1 кг на 1 см2: 1 ат = 98066,5 Па. Это примерно эквивалентно гидростатическому давлению столба воды высотой 10 метров или ртутного столба высотой около 735,56 мм.
В технической и приборной практике могут также использоваться иные единицы, например PSI (фунт-сила на квадратный дюйм), применяемые в англоязычных странах. Ниже приведена таблица, содержащая соотношения различных единиц измерения давления:
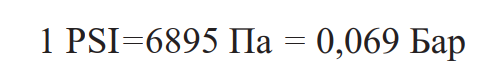 (3)
(3)
Манометры и вакуумметры используются для измерения давления в системах, однако они отображают не абсолютное давление, а разность между ним и атмосферным. Таким образом, они измеряют избыточное давление, при этом калибровка нуля позволяет учитывать влияние высоты над уровнем моря.
| Паскаль | Бар | Тех. атмосфера | Физ. атмосфера | Мм рт. ст. | PSI | Микрон | |
| (Pa) | (bar) | (at) | (atm) | (mmHg) | (psi) | (μκ) | |
| 1 Па | 1 Н/м² | 1·10-5 | 1,0197·10-5 | 9,8692·10-6 | 7,5006·10-3 | 1,4504·10-4 | 7,5 |
| 1 бар | 105 | 1 бар | 1,0197 | 0,98692 | 750,06 | 14,504 | 7,5·105 |
| 1 ат | 98066,5 | 0,980665 | 1 кгс/см² | 0,96784 | 735,56 | 14,223 | 7,356·105 |
| 1 атм | 101325 | 1,01325 | 1,033 | 1 атм | 760 | 14,696 | 7,6·105 |
| 1 mmHg | 133,322 | 1,3332·10-3 | 1,3595·10-3 | 1,3158·10-3 | 1 mmHg | 0,01934 | 1000 |
| 1 psi | 6894,76 | 0,068948 | 0,07031 | 0,068046 | 51,715 | 1 psi | 5,171·104 |
| 1 микрон | 0,1333 | 1,333·10-6 | 1,3595·10-6 | 1,3158·10-6 | 0,001 | 1,9337·10-5 | 1 μκ |
| 1″ Hg | 3386 | 0,33864 | 0,03453 | 0,03342 | 25,4 | 4,9116 | 25400 |
Таблицу с международной системой физических величин (СИ) можно найти по следующей ссылке: Международная система единиц, СИ.
Атмосферное давление (Pатм) представляет собой силу давления, оказываемую воздушной оболочкой планеты на объекты, расположенные на её поверхности.
Абсолютное давление (Pабс) — это суммарное давление, включающее атмосферное и внутреннее давление в системе.
Избыточное давление — это разность между абсолютным и атмосферным давлением. Обычно обозначается как манометрическое (ман, изб и т.п.), и определяется по формуле: ман = абс − атм.
Большинство манометров оснащены устройством настройки нуля, что особенно важно при использовании прибора в условиях пониженного атмосферного давления, например, на возвышенности.
Во многих промышленных и научных задачах возникает необходимость измерения низких значений давления, особенно тех, которые находятся ниже атмосферного уровня. В этих случаях применяется мановакуумметр, способный регистрировать как положительное, так и отрицательное давление относительно атмосферного.
Следует учитывать, что точность работы манометрических приборов постепенно снижается при эксплуатации. Это обусловлено как механическим износом, так и возможными нарушениями герметичности. В связи с этим нормативно предписано выполнять поверку манометров минимум один раз в 1–2 года. Если же выявлено расхождение в показаниях, проводится их калибровка.
Важно соблюдать оптимальный режим эксплуатации манометров: надежнее всего они работают в пределах 75% от максимального значения, указанного на их шкале. Превышение этого значения более чем на четверть может привести к поломке устройства.
Кроме основной шкалы, показывающей давление, современные модели часто снабжены дополнительными шкалами температур насыщения различных хладагентов, что расширяет функциональность устройства (см. рис. 7).

Рисунок 7 – Манометр с нанесёнными температурными шкалами насыщения хладагентов: R134a, R404A, R507, R407C
Плотность – это характеристика вещества, определяемая как масса, приходящаяся на единицу его объема [кг/м3]. Она выражается формулой:
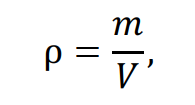 (4)
(4)
где m – масса тела в килограммах; V – объем в кубических метрах.
Удельный объем представляет собой величину, обратную плотности, и указывает, какой объем занимает единица массы вещества [м3/кг]:
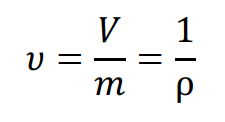 (5)
(5)
Удельная теплоёмкость – это теплофизический параметр, показывающий, сколько теплоты требуется для повышения температуры 1 кг вещества на один градус при постоянных массе и давлении [Дж/кг·градус]:
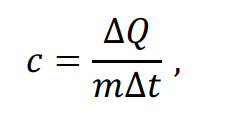 (6)
(6)
где ∆q – количество теплоты, подводимое к веществу; m – масса; ∆t – изменение температуры в Кельвинах.
Данный показатель зависит от температуры вещества, поэтому на практике используют его усреднённое значение в пределах выбранного температурного диапазона.
Удельная теплоемкость бывает:
- Массовой (на единицу массы);
- Молярной (μ) – на один моль вещества.
Кроме того, её делят на:
- Изобарную (при постоянном давлении);
- Изохорную (при постоянном объеме).
Энергия – это величина, характеризующая способность системы совершать работу. В термодинамике принято выделять такие формы энергии, как внутренняя, тепловая, механическая (кинетическая и потенциальная). Единицей измерения энергии является джоуль (Дж).
Первый закон термодинамики формулируется следующим образом: количество теплоты, поступившее в систему, равно сумме изменения внутренней энергии и совершенной системой работы:
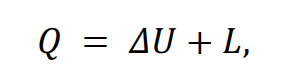 (7)
(7)
где Q – подведенное тепло, U – изменение внутренней энергии, A – работа, совершенная системой.
Внутренняя энергия (U, Дж) – это сумма всех видов энергии, заключённой внутри тела или системы тел, включая кинетическую энергию поступательного и вращательного движения молекул, энергию колебаний атомов, электронов, межмолекулярных и ядерных взаимодействий. В прикладной термодинамике оперируют изменением внутренней энергии, не прибегая к её абсолютному значению.
Второй закон термодинамики утверждает, что теплота не может самопроизвольно передаваться от более холодного тела к более тёплому. Чтобы осуществить такую передачу, необходимо затратить энергию или совершить работу. Кроме того, процессы передачи тепла от горячего к холодному являются необратимыми.
Третий закон термодинамики гласит: невозможно достижение абсолютного нуля температуры, равного −273,15 °C.
Идеальным газом считается газ, в котором взаимодействие между молекулами отсутствует, а собственными размерами молекул можно пренебречь.
Состояние идеального газа описывается уравнением Клапейрона:
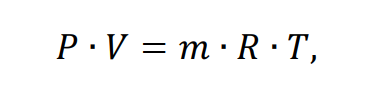 (8)
(8)
Здесь R – удельная газовая постоянная, зависящая от молекулярной массы и универсальной газовой постоянной:
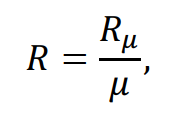 (9)
(9)
Основные параметры термодинамического состояния вещества – давление (p), температура (T) и удельный объем (v) – взаимосвязаны через уравнение состояния:
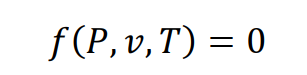 (10)
(10)
Если изменение параметра зависит исключительно от начального и конечного состояния, а не от пути его достижения, такая величина называется функцией состояния.
Энтальпия характеризует энергетический потенциал вещества при постоянном давлении. Удельная энтальпия – это количество энергии, заключённое в 1 кг рабочего тела:
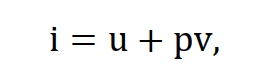 (11)
(11)
где U – внутренняя энергия, p – давление, v – удельный объем.
Энтропия является мерой неупорядоченности системы и отражает уровень рассеивания энергии. Она зависит только от начального и конечного состояния процесса и не определяется его конкретным путем. Энтропия – это функция состояния:
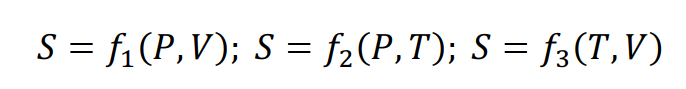 (12)
(12)
Изменение удельной энтропии вычисляется по формуле:
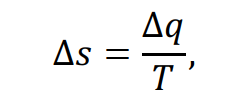 (13)
(13)
где ∆q – теплота, подведенная к системе, T – температура.
Рост энтропии указывает на приток теплоты, а её снижение – на отвод энергии. Таким образом, анализ энтропии позволяет судить о термодинамическом направлении процесса.
В завершение стоит отметить, что рассматриваемые физические и термодинамические параметры — плотность, теплоемкость, внутренняя энергия, энтальпия и энтропия — составляют основу анализа и расчётов в инженерных системах, особенно в теплоэнергетике, холодильной технике и системах кондиционирования. Понимание их сущности и взаимосвязей обеспечивает корректную оценку поведения рабочих тел в самых разнообразных условиях.
Интересные факты:
-
Абсолютный нуль — это не просто холод, а физический предел, при котором прекращается тепловое движение молекул. Температура −273,15 °C недостижима даже в лабораторных условиях.
-
Первый закон термодинамики — частный случай закона сохранения энергии, но для тепловых процессов. Его применение позволило объяснить работу двигателя внутреннего сгорания и паровых машин.
-
Манометры Бурдона, придуманные в 1849 году, до сих пор активно используются в машиностроении, энергетике и HVAC-системах благодаря простоте и надежности.
-
Цельсий и Кельвин — обе шкалы используют одинаковый градус, но начало отсчета в них разное: 0 °C = 273,15 K. Это упрощает математические преобразования при расчетах.
-
Энтропия, хотя и звучит абстрактно, лежит в основе понимания стрелы времени: необратимость процессов связана с её ростом.
Понимание термодинамических параметров и умение их измерять — фундаментальный навык инженера, физика и технолога. Эти параметры описывают состояние вещества и позволяют строить модели сложных процессов, от сгорания топлива до теплообмена в биологических организмах.
Современная техника невозможна без точного контроля температуры и давления, и выбор приборов для этих задач столь же важен, как и знание физических законов, которыми они управляются. Закон сохранения энергии, невозможность достижения абсолютного нуля и необратимость процессов — это не только научные постулаты, но и границы, в которых развивается всё человечество. Понимание этих ограничений позволяет создавать более эффективные и устойчивые технологические решения в энергетике, экологии, машиностроении и строительстве будущего.
