Техническая термодинамика занимает ключевое место в инженерной подготовке, охватывая принципы преобразования энергии, её передачи и сохранения в различных технических системах. Эта дисциплина не только формирует основу понимания процессов, протекающих в тепловых машинах и холодильных установках, но и служит связующим звеном между теоретической физикой и практической инженерной деятельностью.
Через понятия термодинамической системы, процессов и взаимодействия с окружающей средой, техническая термодинамика позволяет описывать, моделировать и оптимизировать сложные энергетические преобразования. Знание термодинамики необходимо в таких отраслях, как энергетика, машиностроение, авиация, металлургия, химическая промышленность и климатотехника.
Истоки термодинамики уходят в глубь XVIII–XIX веков, когда человечество начало активно использовать паровые машины. Первые попытки понять природу тепла предпринимались ещё в античные времена, но только в эпоху промышленной революции возникла необходимость научного осмысления процессов преобразования тепла в механическую работу. Одним из основоположников термодинамики считается французский инженер Сади Карно, который в 1824 году представил модель идеального теплового двигателя — так называемый цикл Карно. Позднее Рудольф Клаузиус сформулировал второй закон термодинамики и ввёл понятие энтропии, а Уильям Томсон (лорд Кельвин) предложил абсолютную шкалу температур. В XX веке термодинамика приобрела прикладной характер в виде технической термодинамики — дисциплины, ставшей необходимой в энергетике, машиностроении и аэрокосмической отрасли.
Техническая термодинамика охватывает широкий круг прикладных задач, связанных с процессами преобразования различных форм энергии, прежде всего тепловой и механической, в технических устройствах, известных как тепловые машины (см. рис. 1). Она тесно связана с такими фундаментальными дисциплинами, как теория теплообмена, гидравлика и основы электротехники, и служит важнейшим теоретическим фундаментом для инженерных направлений, в том числе при проектировании систем холодильной техники и теплотехнологических установок.

Рисунок 1 – Ответвления термодинамики
Суть термодинамики определяется двумя ключевыми законами, формирующими основу ее математической модели:
- Первый закон термодинамики формулирует принцип сохранения энергии, утверждая, что энергия не исчезает бесследно и не возникает из ничего, а переходит из одной формы в другую.
- Второй закон термодинамики устанавливает принцип направленности происходящих процессов, подчеркивая невозможность полной трансформации тепла в механическую работу без сопутствующих изменений.
Главным предметом изучения данной науки выступает термодинамическая система, под которой принято понимать мысленно или физически обособленный объем, содержащий тело или несколько тел, с определёнными свойствами. Эта система обменивается с окружающей средой теплом, массой и работой, либо может быть изолирована от этих процессов.
Средой, взаимодействующей с системой извне, называют окружающей средой. Она включает все физические объекты и явления за пределами исследуемой системы. На схеме ниже (рис. 2) показано одно из типичных взаимодействий: газ внутри цилиндра с поршнем, где газ — термодинамическая система, а корпус, поршень и воздух вокруг — окружающая среда.
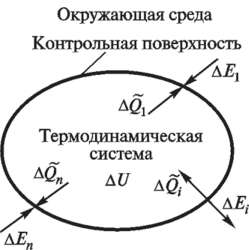
Рисунок 2 – Термодинамическая система
Процесс, сопровождающий обмен энергией между системой и её окружением, обозначается как термодинамический процесс. Он характеризуется изменением как минимум одного термодинамического параметра, среди которых наиболее значимыми являются температура, давление и объем.
Термодинамические системы можно классифицировать следующим образом:
- Изолированная система — полностью отгорожена от внешней среды, исключая все виды взаимодействия, включая теплообмен и обмен веществом.
- Адиабатная система — тип, в котором теплообмен невозможен, но возможен обмен механической энергией.
- Однородная система — система, в которой все её части имеют идентичный физико-химический состав и характеристики.
Среди наиболее часто рассматриваемых процессов в термодинамике выделяются следующие:
- Изохорный процесс — протекает при постоянном объеме (∆ν = 0);
- Изобарный процесс — проходит при неизменном давлении (∆P = 0);
- Изотермический процесс — характеризуется постоянной температурой (∆T = 0);
- Адиабатный процесс — тепло не поступает в систему и не уходит из неё (q = 0).
В рамках термодинамического взаимодействия можно выделить две основные формы передачи энергии:
- через тепловой поток,
- посредством выполнения механической работы.
Для получения более полного понимания этих процессов, рекомендуется обратиться к специальной литературе, в которой рассмотрены подробности моделирования, расчётов и приложений технической термодинамики.
Механическая работа в термодинамике определяется как энергия, передающаяся за счет изменения состояния системы — например, при сжатии газа в цилиндре. Это не только перемещение массы, но и модификация её внутреннего состояния — температуры, давления и объема.
Передача энергии также возможна за счёт тепловых потоков, происходящих через:
- Теплопроводность — передача энергии от более нагретых участков тела к менее нагретым в пределах одного вещества или через соприкасающиеся тела. Этот механизм зависит от материала (рис. 3);
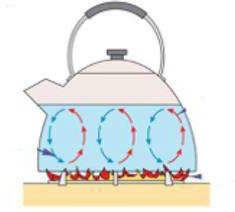
- Конвекцию — перемещение тепла с участием движения жидкости или газа. Конвекция бывает естественной (возникающей самопроизвольно) и вынужденной (вызванной техническими устройствами) (рис. 4);
- Излучение — передача энергии в виде электромагнитных волн, интенсивность которых определяется законом Стефана-Больцмана.
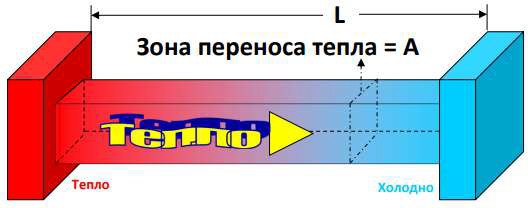
Рисунок 3 – Теплопроводность

а) б)
Рисунок 4 – Конвекция: а) вынужденная, б) естественная
Важнейшими понятиями, с которыми работает термодинамика, являются:
- Работа — величина, характеризующая механическое воздействие между телами;
- Количество теплоты — энергетическая мера теплового обмена между объектами.
Кроме того, в термодинамике анализируются такие процессы, как:
- Равновесный процесс — характеризуется плавным, квазистатическим изменением параметров, при котором система в каждый момент времени близка к равновесию.
- Обратимый процесс — процесс, направление которого можно изменить, вернув систему в начальное состояние без изменения параметров окружающей среды.
- Необратимый процесс — сопровождается увеличением энтропии и невозможностью восстановления исходного состояния системы и среды без внешнего вмешательства.
- Круговой процесс (цикл) — особый тип термодинамического процесса, в ходе которого параметры возвращаются к первоначальным значениям. Пример — цикл Карно, цикл Ренкина и другие.
Таким образом, техническая термодинамика представляет собой комплексную научную дисциплину, позволяющую не только количественно анализировать энергетические превращения, но и оптимизировать работу систем, использующих тепловую и механическую энергию в промышленных и бытовых установках.
Интересные факты о термодинамике:
-
В основе холодильника лежит принцип обратного термодинамического цикла, где система забирает тепло у более холодного тела и отдает его более тёплому — вопреки «интуитивному» направлению теплового потока.
-
Энтропия — ключевое понятие термодинамики — изначально трактовалась как «мерило беспорядка», но с развитием статистической физики обрела более точную математическую интерпретацию.
-
Современные термодинамические принципы лежат не только в основе тепловых двигателей, но и в функционировании солнечных батарей, атомных электростанций, реактивных двигателей, а также в разработке технологий хранения энергии.
-
Закон сохранения энергии, который составляет первый закон термодинамики, в современной физике считается универсальным — он работает как в паровых котлах, так и на квантовом уровне в микромире.
-
Температура абсолютного нуля (−273,15°C) — это теоретическая точка, при которой прекращается любое тепловое движение частиц. Этот предел недостижим на практике, но к нему стремятся при исследованиях сверхпроводимости и квантовых эффектов.
Техническая термодинамика представляет собой не просто теоретическую науку, а мощный инструмент анализа и оптимизации процессов, лежащих в основе функционирования практически всех технических систем, связанных с энергией. От понимания простейших термодинамических процессов до моделирования сложных тепловых циклов — всё это составляет ядро инженерной подготовки и научных исследований. Освоение термодинамических законов позволяет проектировать энергосберегающие технологии, совершенствовать тепловые двигатели, холодильные установки и системы отопления, а также разрабатывать новые принципы в области альтернативной энергетики.
