Люминесцентными материалами (люминофорами) называются такие материалы, которые способны люминесцировать, т.е. отдавать в виде светового излучения (без испускания тепловых лучей) поглощенную ими энергию возбуждения. Люминесценция может проявляться при довольно низких температурах, поскольку не использует тепловую энергию излучающей системы. Поэтому люминесценцию часто называют «холодным свечением». В отличие от других видов нетеплового излучения (например, рассеяния и отражения света) люминесценция характеризуется более продолжительным временем свечения, которое может составлять от 10-12 с до нескольких суток.
Согласно квантовой теории электроны в атомах (молекулах) расположены на определенных энергетических уровнях. При облучении вещества светом возможен переход электронов между различными энергетическими уровнями. Разница энергии между энергетическими уровнями Е1 и Е2 и частота v волны поглощенного света соотносятся между собой уравнением
Е1 – Е2 = hv,
где h – постоянная Планка.
После поглощения света часть полученной системой энергии расходуется в результате релаксации (перехода в равновесное состояние), часть же может быть испущена в виде фотона определённой энергии.
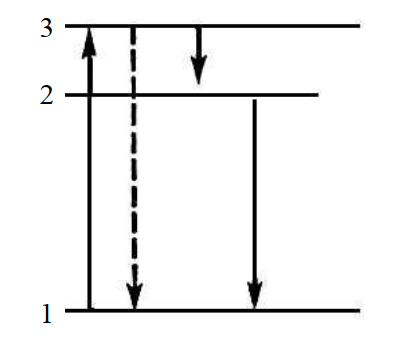
Рис. 1. Схема квантовых переходов при элементарном процессе люминесценции: 1 – основной энергетический уровень; 2 – уровень излучения; 3 – уровень возбуждения.
Переход 3 → 1 (показан пунктирной стрелкой) соответствует резонансной люминесценции, переход 2 → 1 – спонтанной люминесценции
Некоторые из возможных механизмов реализации процесса люминесценции схематично показаны на рис. 1. При возбуждении люминесценции атом (молекула), поглощая энергию, переходит с основного уровня энергии 1 на возбуждённый уровень 3. В некоторых случаях люминесценция может происходить непосредственно при излучательном переходе 3 → 1. При этом частоты (длины волн) люминесценции и возбуждающего света совпадают, а люминесценция называется резонансной. В других случаях при взаимодействии с окружающими атомами возбуждённый атом может передать им часть энергии и перейти на уровень 2, при излучательном переходе с которого и происходит люминесценция, которая называется спонтанной. Обычно уровень испускания излучения 2 лежит ниже уровня 3, часть энергии при возбуждении теряется на тепло, так что длина волны испущенного света оказывается больше, чем поглощённого (правило Стокса, установлено английским физиком Дж. Г. Стоксом в 1852 г.).
Излучающий атом также может получать дополнительную энергию от других атомов, так что длина волны испущенного света оказывается меньше, чем поглощённого. Эта добавочная энергия может быть как энергией теплового движения атомов, так и результатом суммирования энергии возбуждения, т.е. передачи энергии, поглощённой несколькими атомами, одному излучающему атому.
В некоторых случаях атом (молекула), прежде чем перейти на уровень испускания 2, оказывается на промежуточном (более низком) метастабильном уровне и для перехода на уровень 2 ему необходимо сообщить дополнительную энергию, например, энергию теплового движения или света. Люминесценция, возникающая при таких процессах, называется метастабильной (вынужденной или стимулированной).
Уровень испускания может принадлежать как тому же атому (молекуле), который поглотил энергию возбуждения (такие переходы называются внутрицентровыми), так и другой частице. Передача энергии другим атомам и молекулам осуществляется электронами и может происходить различными путями. Так, в кристаллах передача энергии осуществляется с помощью электронов проводимости, дырок и электронно-дырочных пар. Если при этом заключительным актом передачи энергии становится рекомбинация (в частности, рекомбинация электронов и дырок), то сопровождающая этот процесс люминесценция называется рекомбинационной.
Способностью к люминесценции могут обладать вещества, находящиеся в твердом, жидком и газообразном состояниях. Специально синтезируемые вещества, способность к люминесценции которых используется для практических целей, называются люминофорами. Люминесценция делится на различные виды в зависимости от типа возбуждения. Основными из них являются фото-, радио-, электро- и хемилюминесция. Соответственно, по типу возбуждения различают фото-, радио-, электро- и хемилюминофоры. Существуют также люминофоры смешанных типов, например, ZnS:Cu является фото-, катодо- и электролюминофором. По химической природе люминофоры бывают органическими (органолюминофоры) и неорганическими (фосфоры). Фосфоры с кристаллической структурой называются кристаллофосфорами. Свечение люминофоров может быть обусловлено как свойствами основного вещества (основания), так и наличием примеси – активатора, образующего в основании центры свечения. При этом название активированных люминофоров складывается из названия оснований и названия активаторов, например, ZnS:Cu обозначает сульфид цинка, активированный медью (зеленый цвет свечения), или ZnS:Ag обозначает сульфид цинка, активированный серебром (синий цвет свечения).

