Содержание страницы
Нанотехнология позволяет ученым, инженерам и медикам перейти к крупномасштабным исследованиям в области биологии и здравоохранения на клеточном и молекулярном уровне. В 21 в. эти исследования приведут к новым биотехнологическим производственным процессам, а также к принципиальным изменениям в методах медицины.
Благодаря развитию сканирующей микроскопии и аналитических методов оптического сканирования в последние годы ученым удалось наблюдать химические процессы и микроскопические структуры в биологических системах с недостижимым ранее разрешением. Новейшие аналитические методы дают возможность детально изучать микроскопическое строение живых клеток и химических процессов на молекулярном уровне. Например, АСМ позволяет выявлять направление и величину очень слабых молекулярных сил, определяющих связи рецептор-лиганд на поверхности клеток. Микроскопические электронные зонды позволяют измерять параметры ионного обмена клетки с окружением или величину электрического тока в нервных волокнах. Новейшие высокоразрешающие оптические приборы в сочетании с флуоресцентными светоизлучающими зондами, обладающими химической селективностью, позволяют изучать химические процессы на поверхности и внутри живой клетки. Такая аналитическая аппаратура дает возможность исследовать биохимические процессы и взаимодействия клеток внутри организма.
Биологические клетки содержат внутри себя естественные «молекулярные двигатели» совершенной конструкции. Примером таких природных наномашин является Fl-АТФаза, представляющая собой часть значительно более крупного, встроенного в мембрану комплекса, обеспечивающего синтез АТФазы в митохондриях (рис. 41). Размеры данной структуры не превышают 10 нм, и она представляет собой весьма надежный и функционально совершенный двигатель, работа которого обеспечивается естественными биохимии ческими процессами. В 1998 г. премия Амершама по биотехнологии и фармакологии была вручена молодому японскому исследователю Хироюки Нодзи, которому удалось экспериментально продемонстрировать работу этого молекулярного двигателя, присоединив к нему длинное молекулярное актиновое волокно и проследив его вращение в оптическом микроскопе.
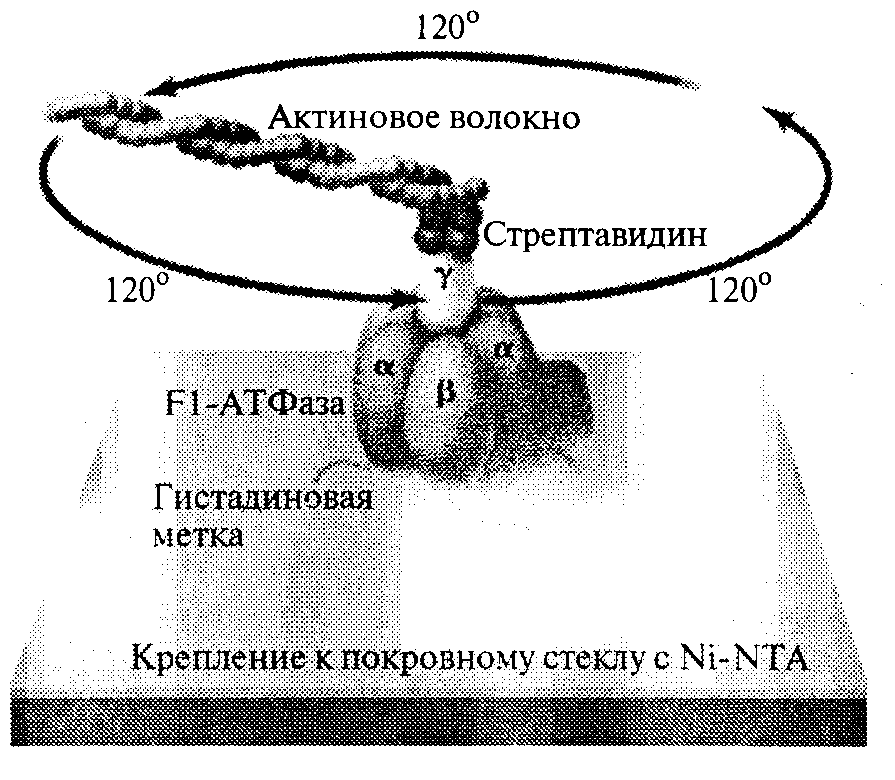
Рис. 41. Молекулярный протеиновый двигатель Fl-АТФаза.
На рисунке из журнала Science показано актиновое волокно, прикрепленное к ротору двигателя. Вращение волокна, создаваемое протеиновым двигателем, позволяет наблюдать в микроскопе его работу (© 1998 American Association for the Advancement of Science).
Детальное исследование строения и функционирования этого протеинового двигателя (и аналогичных ему молекулярных биосистем) имеет огромную научную и практическую ценность.
В последние несколько лет ученые разработали технологию быстрого картирования генетической информации в молекулах ДНК и РНК, включая определение мутаций и уровней экспрессии. В этой технологии используется матрица микрочипов ДНК, что имеет сходство с литографической технологией формирования рисунка при промышленном производстве интегральных схем. В настоящее время технологии такого типа приобретают коммерческое значение и находят применение в биотехнологических исследованиях и производственных процессах. Разработка новых типов химических матриц позволит расширить возможности таких технологий и применить их, например, в биологических устройствах обработки информации или для анализа белков и других биомолекул. Миниатюризация устройств на основе родственных аналитических процессов, в частности электрофореза, повышает эффективность таких технологий и снижает стоимость многих важных аналитических методик, например секвенирования ДНК или создания фингерпринтов (пептидных карт).
Используя биологические системы в качестве образца, ученые пытаются создать путем самосборки еще более сложные системы. Самосборка становится необходимым условием во многих процессах, поскольку уменьшение размеров компонентов делает манипулирование ими слишком медленным для практических целей. Сложные биологические системы можно рассматривать как модели, по которым создаются отдельные компоненты, объединяемые в дальнейшем единственным возможным способом в требуемую трехмерную нано-структурную систему. Для создания новых материалов можно воспользоваться знаниями, полученными при исследовании биологических систем. Например, изучив молекулярную структуру паутины (которая является одним из самых прочных материалов, известных в настоящее время), можно использовать полученные данные для конструирования новых композитных полимерных материалов, обладающих повышенной прочностью.
Наночастицы, диаметр которых намного меньше 1 мкм, были использованы для разработки эффективных методов доставки лекарственных препаратов и генов внутрь клеток. Дело в том, что многие ценные лекарственные препараты нерастворимы в воде и часто с трудом проникают внутрь клеток. Однако такие соединения можно связать с наночастицами указанных размеров. Частицы-носители движутся в кровотоке, почти не создавая опасности за купорки капилляров и других мелких кровеносных сосудов (что обычно происходит при введении в кровь нерастворимых порошков). Метод позволяет существенно повысить эффективность и скорость воздействия лекарственных препаратов на ткани человеческого организма. Аналогично, наночастицы, переносящие на себе фрагменты ДНК, могут использоваться для введения специфических генов в намеченные клетки организма 42.

Рис. 42. Устройство называемое «генным ружьем», с помощью которого наночастицы используются для доставки генетического материала (трансфекции) в клетки растений и животных. В системе доставки применяются субмикрометровые частицы золота, покрытые ДНК, которые ускоряются сверхзвуковым потоком газообразного гелия. Вылетающие из устройства высокоскоростные частицы пробивают клеточную и ядерную мембраны и вводят генетический материал непосредственно в ядро клетки (фото Bio-Rad Laboratories).
Способность макромолекул ДНК к регулируемой и высокоорганизованной сборке делает их идеальным материалом для нанотехнологий. Например, молекулы ДНК применялись для конструирования матриц, которые путем самосборки легко превращаются в запланированные двухмерные структуры. Эти матрицы состоят из жестких пластинок ДНК (площадью около 60 нм2), образованных антипараллельными цепями ДНК, которые соединены двойными перекрестными связями, аналогичными тем, которые наблюдаются при редукционном делении клеток (мейозе). Точную форму и периодичность расположения пластинок можно модифицировать, изменяя последовательность азотистых оснований ДНК, что позволяет формировать специфические решетки с наноразмерными программируемыми структурами. Такой подход в будущем может привести к использованию сконструированных ДНК-кристаллов в качестве основы для кристаллизации макромолекул, для создания новых катализаторов и молекулярных сит, для сборки молекулярных электронных схем или биочипов будущих ДНК-компьютеров. Аналогично, субстраты и подложки из биомолекул могут применяться для исследования уникальных структурных особенностей РНК и полипептидных цепочек или при проведении высокоспецифичных реакций между нуклеиновыми кислотами и белками.
Устройства, которые используются сейчас для регулирования взаимодействия ДНК на поверхностях, могут найти применение для управления процессами самосборки. В этих устройствах электрические поля используются для установки частиц в определенных позициях (или поверхности. Такой же подход может использоваться и для точной установки заряженных биологических молекул (ДНК, РНК, белки), клеток и других наноразмерных или микроскопических заряженных частиц.
Описанные выше достижения нанотехнологии и наносинтеза перспективны как для научных исследований, так и для коммерческих приложений. Дальнейшая миниатюризация и развитие струйной техники, фотоники и электроники ведут к смене парадигм в химическом синтезе и анализе. Некоторые отрасли промышленности, которые сейчас не относятся к высоким технологиям, в 21 в. благодаря достижениям нанотехнологии полностью изменят свой характер.
Тщательное изучение работы живых клеток (с учетом наличия наноразмер-ных рецепторов, пор и других функциональных компонентов) станет возможным после создания нового класса наноразмерных зондов. Нанотехнология повысит чувствительность и интеграцию аналитических методов, что позволит более связно и последовательно описывать процессы, происходящие в живых организмах. Способность манипулировать отдельными клетками и присоединять их к сложным неорганическим устройствам и зондам позволит ученым провести эксперименты нового типа по исследованию функционирования клеток. Например, при изучении воздействия лекарственных препаратов или опасных веществ подопытные животные могут быть заменены на сенсоры с культивированными клетками.
1. Биологический нанокомплекс для переноса лекарственных соединений
На рис. 40 представлен новый противораковый нанокомплекс РК1, который переносит к опухоли лечебный препарат цитотоксин (доксорубицин). Процесс направленного переноса обусловлен эффектом повышенной проницаемости и удерживания комплекса в пораженных болезнью тканях, где нарушена целостность сосудистой системы организма. Идея метода заключается в том, что 1Ч-2-(гидроксипропил)метакриламид, составляющий основу препарата РК1, образует наноразмерный комплекс, который из-за своих размеров не может проникать с кровотоком в здоровые ткани организма. Однако в пораженных раком тканях проницаемость сосудистой системы резко возрастает, вследствие чего в них проникают комплексы РК1. Доксорубицин, связанный с комплексом, не является токсичным и не представляет угрозы здоровым тканям
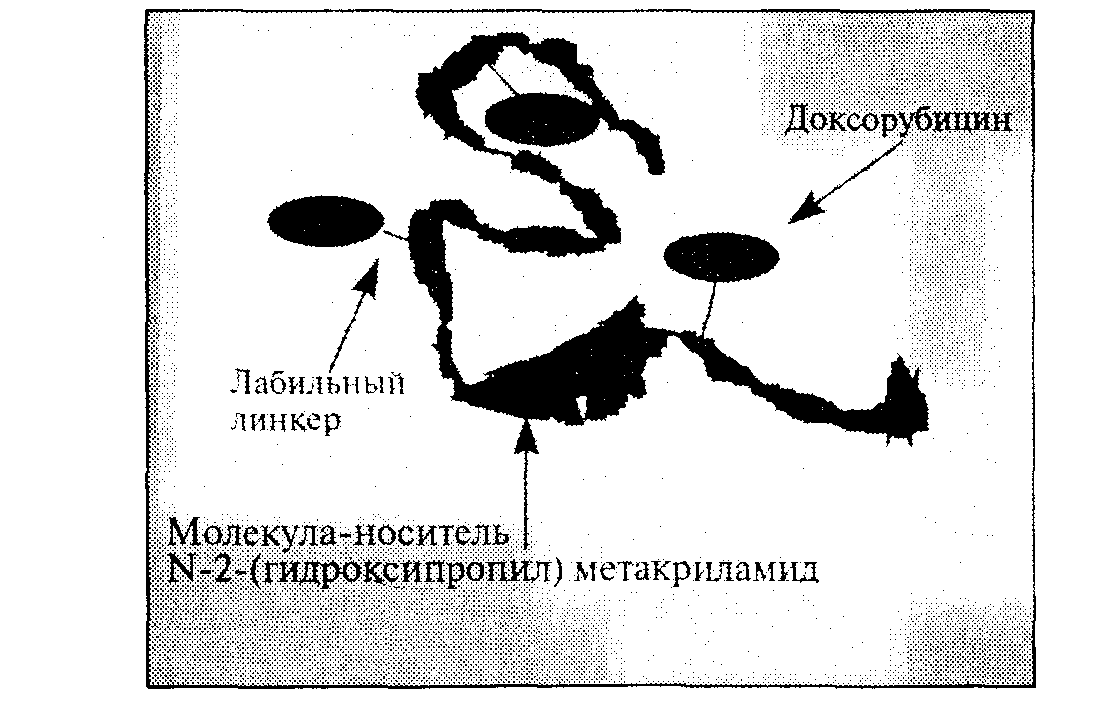
Рис. 40. Биологический противораковый нанокомплекс РК1
В своей активной форме он высвобождается главным образом внутри пораженных тканей. Объединение М-2-(гидроксипропил)метакриламида и доксо-рубицина в единый комплекс осуществляется при помощи связывающего агента, в качестве которого был выбран лабильный пептидный линкер, так как он является питательной средой для протеазы (известно, что опухолевые ткани производят протеазу в повышенных количествах). Использование РК1 позволяет более чем на порядок повысить применяемые дозы доксорубицина, как с помощью направленного переноса, так и из-за преимущественного выделения доксорубицина в пораженных тканях. Метод проходит клинические испытания в Европе. Дополнительным преимуществом данного препарата и аналогичных средств на полимерной основе является то, что в них используются монодисперсные нанополимеры (дендритного строения), что позволяет управлять эффектом направленного переноса, а также вводить так называемые домены «причаливания» (дающие возможность антигенам связывать комплекс именно при поступлении в зону опухоли) или добавлять другие антираковые препараты, обладающие синергизмом действия с цитотоксинами, включая ан-гиостатические агенты.
2. Разработка лекарственных препаратов
Применение нанотехнологий может резко ускорить процессы получения новых лекарственных препаратов, включая этапы синтеза, обработки и производства. Применение новых технологий позволило за последние годы намного повысить быстродействие процессоров и объем памяти ЭВМ. Аналогичный подход к скриннингу новых лекарственных соединений в период с 1998 по 2000 г. позволил только с помощью миниатюризации оборудования примерно в 10 раз увеличить число проверяемых фармацевтических препаратов. В этом есть сходство с экспоненциальным нарастанием эффективности микроэлектронных устройств. В фармацевтических лабораториях сейчас заменяется громоздкое оборудование (предназначенное для исследования сотен тысяч образцов культур клеток) на новые устройства, содержащие огромное число микрососудов (объемом около 1 нл) с разнообразными культурами, что позволяет существенно повысить скорость скриннинга и сократить сроки запуска новых лекарств в производство.
3. Направленная доставка лекарств
Доставка лекарств и генов в заданные точки организма и ткани будет все шире внедряться в медицинскую практику. Применение нанотехнологий позволяет использовать огромные возможности многих водонерастворимых и нестабильных соединений. Микродатчики, соединенные с наноустройствами доставки, будут обеспечивать поступление точно заданных количеств препаратов с учетом их функциональности и токсичности. Еще большие перемены могут быть связаны с промышленным производством наноча-стиц-носителей, что, возможно, позволит реализовать доставку требуемых препаратов в заданные клетки организма. Дальнейшее уменьшение размеров частиц-носителей и разработка способов присоединения к таким частицам лигандов направленного действия поможет доставлять препараты к определенным тканям. Эти же частицы могут использоваться в исследованиях фундаментальных биологических процессов на клеточном уровне, например, опосредованного рецепторами эндоцитоза и внутриклеточной направленной миграции.
4. Разработка биосовместимых поверхностей контакта
Одна из важнейших проблем современной медицины, связанная с протезированием и использованием искусственных органов, обусловлена необходимостью разработки поверхностей контакта биологических тканей с неорганическими материалами. Известно, что реакция отторжения имплантируемых материалов определяется их химическими и топографическими особенностями в наномасштабе. Поэтому необходимы тщательные исследования биологических реакций на поверхностях контакта. Использование имплантируемых тканей с нанометровым защитным покрытием, препятствующим отторжению, возможно, позволит увеличить количество применяемых донорских органов. Использование более качественных материалов и понимание механизмов их взаимодействия с биологическими тканями может привести к созданию таких имплантантов, которые практически будут интегрированы в организм. Изготовление наноструктурных материалов для этих целей стало бы важным направлением развития медицины.
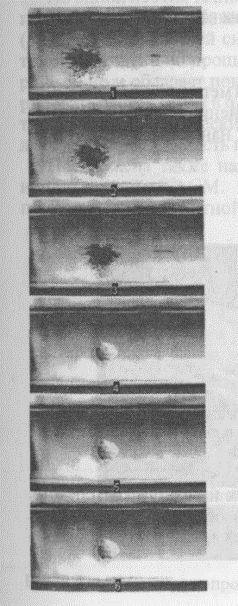
Рис. 44. Лазерно-направляемый перенос отдельной клетки спинного мозга вдоль полого оптического волокна (диаметр клетки 9 мкм, интервал времени между снимками 300 мс). Лазерное излучение падает слева и придает клетке мощный импульс. Изменяя направление лазерного луча, можно осадить клетки на поверхности, создав из них требуемую конфигурацию. Аналогично можно управлять движением субклеточных частиц (-100-500 нм).
5. Биологическое детектирование боевых отравляющих веществ
Нанотехнология может внести коренные изменения в методы защиты от химического и биологического оружия. Например, объединение химических, физических и биологических подходов позволяет создать наноразмерные датчики нового типа для обнаружения боевых биологических и химических средств. Такие устройства могут найти применение также в обычной медицинской практике и при ликвидации последствий природных катастроф. Необходимость разработки подобных датчиков не вызывает сомнений, поскольку, например, в известном инциденте с применением в 1995 г. террористами секты «Аум сенрике» химического оружия полиция для обнаружения нервно-паралитического газа использовала канареек (рис. 45). В рамках оборонных программ сейчас разрабатываются несколько типов таких датчиков. Две технологии уже близки к внедрению в производство и могут найти применение также в медицине.

Рис. 45. Использование канареек в качестве индикаторов отравляющего газа (фото из газеты «Санкэй симбун»).
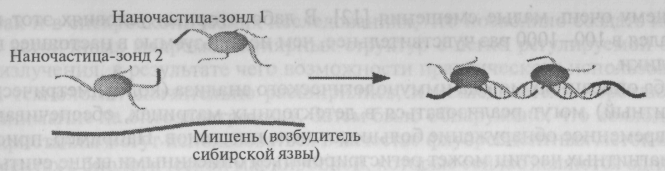
Рис. 46. Регистрация возбудителей сибирской язвы. При наличии возбудителя две наночастицы объединяются посредством участков ДНК, что приводит к изменению цвета суспензии (рисунок от С. Mirkin, Northwestern University).
По одной из этих технологий был создан колориметрический датчик биологических агентов ДНК, который успешно прошел испытания по обнаружению (рис. 46.) возбудителей сибирской язвы и туберкулеза. Новый датчик не только значительно проще и дешевле (примерно в 10 раз) существующих устройств, но и обладает повышенной чувствительностью — он может зарегистрировать расхождение в один нуклеотид для последовательности из 24 нуклеоидов (для статистически достоверной идентификации необходимо определить последовательность из 17 нуклеотидов).
Предложена также нанотехнология (рис. 47) биохимического анализа с использованием АСМ. Иммунопроба, обладающая сэндвич-структурой, помещается на магнитной частице, прикрепленной к микрорычагу, регистри рующему очень малые смещения. В лабораторных условиях этот метод оказался в 100—1000 раз чувствительнее, чем используемые в настоящее время методики.

Рис. 47. АСМ с иммунопробой (1996 American Vacuum Society).
Оба описанных метода иммунологического анализа (колориметрический и магнитный) могут реализоваться в детекторных матрицах, обеспечивающих одновременное обнаружение большого числа патогенов. Например, присутствие магнитных частиц может регистрироваться описанными выше считывающими устройствами с эффектом ГМС.
