В настоящее время остро стоит вопрос о поиске альтернативных источников энергии и разработке новых энергетических технологий, связанных с получением энергии и тепла с помощью возобновляемых ресурсов и сырья (энергии солнца, ветра, воды, биомассы различного происхождения). Одним из перспективных направлений в данной области, стремительно набирающим обороты, является получение альтернативных видов топлива из возобновляемого природного сырья: растительной, животной и микробной биомассы, – имеющего практически неограниченные запасы. [1, 2, 3].
Всевозрастающее внимание к биомассе связано, в первую очередь, с безвозвратным истощением мировых запасов ископаемого топлива, а также стремлением к энергосбережению и сокращению выделения в окружающую среду парниковых газов. Прогнозы на ближайшее будущее по запасам нефти и газа являются весьма пессимистичными. В качестве примера можно привести данные организации стран-экспортеров нефти (ОПЕК) насчёт запасов России: разведанных запасов нефти хватит до 2025–2030 гг., запасов газа – до 2085-2095 гг. [3]. Мировые цены на нефть неизбежно растут, и прогнозируется их дальнейшее повышение. Таким образом, в условиях непрекращающегося роста цен на горючие полезные ископаемые и исчерпания их запасов получение и использование в различных секторах экономики (промышленность, транспорт, сельское хозяйство) в России, а также во всём мире традиционных видов топлива становится экономически неоправданным.
Биомасса, как отмечалось выше, в качестве источника энергии находит все более широкое распространение. На данный момент она занимает шестое место по запасам среди доступных источников энергии после горючих сланцев, урана, угля, нефти, природного газа и пятое по производительности после прямой солнечной, ветряной, гидро- и геотермальной энергии [4, 5]. Биомассу подразделяют на древесную (до 80 %), травяную и плодовую, также к ней относят отходы пищевой, сельскохозяйственной и лесоперерабатывающей промышленностей [6]. В России ежегодно накапливается до 270 млн. тонн (по сухому веществу) органических отходов, из них 230 млн. тонн составляют сельскохозяйственные отходы и 50 млн. тонн – ТБО (твёрдые бытовые отходы) [7]. В связи с чем, проблема поиска дешёвого альтернативного источник энергии может быть решена вкупе с проблемой утилизации крупнотоннажных отходов.
В течение последнего десятилетия можно наблюдать значительное возрастание интереса к водородной энергетике, что обусловлено необходимостью создания экономически эффективной и экологически безопасной системы энергообеспечения жизнедеятельности человека и функционирования объектов экономики [4, 8]. По экспертным оценкам водород является весьма перспективным экологически чистым топливом, практически единственным продуктом сгорания которого является вода [4, 9]. Помимо высокой теплоты сгорания (122 кДж/г), ещё одним важным преимуществом его использования в качестве энергоносителя является исключение выделения парниковых газов и других загрязнений в окружающую среду и снижение выброса углекислого газа в атмосферу [8]. Следует также отметить, что выбор водорода в качестве источника энергии определяется возможностью его получения из практически не ограниченного по запасам сырья: отходов сельскохозяйственных предприятий, пищевых и лесоперерабатывающих производств и воды. В последнее время повышенное внимание уделяют также такому виду сырья, как биомассе кислород-продуцирующих микроорганизмов: микроводорослям и цианобактериям, – так как она является перспективным углеводсодержащим субстратом для анаэробного сбраживания бактериями, образующими водород [4, 10]. Использование водород-образующих микроорганизмов позволяет одновременно разработать технологию получения водорода и решить проблему переработки отходов путём их микробной конверсии. Более детально данный процесс будет рассмотрен позже.
Реализация производства водородного топлива в первую очередь связана с поиском и разработкой экономичной и экологически безопасной технологии его получения. В связи с чем, огромный научно-практический интерес и актуальность представляют биологические методы получения водорода с использованием микроорганизмов в качестве каталитических систем для процесса его образования. Впоследствии возник термин «биоводород», обозначающий водород, полученный биологическим (микробиологическим) способом. В данном обзоре эти способы будут подробно рассмотрены. Многие исследовательские разработки, посвящённые получению водорода, направлены на использование в качестве исходного сырья крахмало- и целлюлозосодержащих отходов, легко превращаемых в сахара, тем самым способствуя решению проблемы утилизации многотоннажных отходов различных отраслей промышленности.
Исходя из описанного выше, исследования, проводимые в направлении разработки технологий получения биоводорода с помощью микроорганизмов из возобновляемых органических отходов, являются весьма актуальными и современными.
На сегодняшний день основную часть водорода в промышленных масштабах получают термохимическими способами путём паровой конверсией метана, каталитической конверсией углеводородов или газификацией угля [4]. Например, в США паровым риформингом природного газа производят 90 % от общего объёма получаемого в мире водорода [8]. Существенным недостатком данных методов является наличие высоких выбросов СО2 в атмосферу. Помимо этого, в технологическом процессе получения водорода данными способами используют высокопотенциальную энергию, на получение которой, в свою очередь, затрачивают дефицитное ископаемое топливо (нефтепродукты, уголь, природный газ), что делает такое производство экономически не целесообразным в современных условиях.
Рассмотрим кратко термохимические способы получения водорода. Паровой риформинг широко применяют для получения водорода из лёгких фракций углеводородов (например, метана) и сырой нефти. Процесс состоит из следующих стадий:
- эндотермической реакции парового риформинга: конверсии углеводородов в водород и моноокись углерода в присутствии водяного пара: CH4 + H2O = CO + 3H2, ΔHр = 4205 кДж/моль;
- экзотермической реакции конверсии монооксида углерода в присутствии водяного пара в водород и диокисд углерода: СО + H2O = CO2 + H2, ΔHр = – 41 кДж/моль. [11]
Кроме того, необходимо проведение вспомогательных процессов, включающих возврат тепла и производство пара, извлечение получаемого водорода. Используемые в процессе парового риформинга катализаторы очень чувствительны к содержанию серных примесей в газах. Поэтому для предотвращения отравления катализатора необходимо предварительно проводить десульфуризацию сырья [8]. Также в промышленности распространён способ получения водорода путём частичного окисления углеводородов, в котором в качестве сырья чаще всего используют отходы нефтеперегонных заводов. В данном процессе происходит некаталитическое эндотермическое превращение тяжёлых углеводородных фракций (например, остаточных углеводородов после обработки сырой нефти) посредством окисления их кислородом в синтез-газ с высоким содержанием CO [12]. Уравнение общей реакции, включающей несколько подреакций, выглядит следующим образом:
СmHn + n/2О2 = nCO + m/2 H2.
Для частичного окисления используют разное сырьё, при этом его десульфуризация не требуется. Процесс осуществляют при температурах 1300-1400 °C.
Производство водорода в больших масштабах посредством технологии парового риформинга не теряет актуальности в силу дешевизны и эффективности данного способа. Производительность завода по водороду, использующего этот метод, составляет свыше 100 тыс м3/ч.
Нельзя не отметить, что в последнее время уделяют внимание созданию небольших производств, отвечающих требованиям рынка, заинтересованного в малых количествах водорода. К этому можно отнести синтез данного энергоносителя с помощью электролиза, используемого чаще всего для получения водорода высокой степени частоты. Однако из-за высокой стоимости электроэнергии электролиз является весьма дорогим способом. Доля водорода в мировом производстве, полученного таким образом, не превышает 5 % [13]. К тому же, мощность электролизёрных установок по водороду очень низка и достигает не более 1 м3/ч. Несмотря на это, исследователи ищут различные способы удешевления процессов электролиза воды. Например, авторы работы [9,14] разработали процесс с использованием установки со специальными объемно-пористыми электродами с низким перенапряжением выделения водорода. Как отмечают исследователи, преимуществами этой разработки являются возможность получения чистого водорода и более низкие энергозатраты. Электролиз является физико-химическим процессом, протекающим в растворах или расплавах электролитов при пропускании через них электрического тока. Различают три основных вида электролиза в зависимости от вида электролита и типа электролитической установки:
- щелочной: раствор щелочного электролита, 80 °C;
- мембранный: протон-проницаемая мембрана, 80 °C;
- паровой: керамическая мембрана, содержащая ион кислорода, 650-1000 °C. [8]
Чаще всего для получения водорода применяют электролиз водного раствора щелочного электролита, например, раствора едкого натра, так как в данном случае повышается электропроводность раствора и уменьшается расход на электроэнергию. Натрий не восстанавливаются на катоде, а остаётся в растворе, в то время как вода на катоде подвергается разложению на водород и кислород. Электролиз водного раствора гидроксида натрия описывают следующими электрохимическими реакциями:
- на катоде: 2H2O + 2e— = H2 + 2 OH−
- на аноде: OH− = O2 + 2H2O + 4e—
- суммарное уравнение: 2H2O = O2 + 2H2.
Обычно процесс осуществляют при нормальных внешних условиях. Но можно проводить электролиз и при высоком давлении (до 30 бар), что является преимущественным, когда полученный водород нужно сохранить под давлением. Получаемые газы, водород и кислород, собирают раздельно, однако они не полностью свободны от примесей, и, к тому же, насыщены парами воды. Большинство современных электролитических установок включают модули, позволяющие удалять пары воды. Степень частоты водорода, полученного способом электролиза, варьируется между 99,9-99,9998 объёмными % в зависимости от применяемой электролитической системы [8].
Получение водорода в небольших объёмах также можно организовать с помощью его производства путём каталитического парового риформинга метанола [15]. Протекает процесс при температуре 250-300 °C и давлении 20 бар и состоит из следующих стадий:
- СН3ОН = СО + 2Н2, ΔHр = – 91 кДж/моль;
- СО + Н2О = СО2 + Н2, ΔHр = – 41 кДж/моль.
Специалисты отмечают, что современные разработки по технологии получения водорода становятся более ориентированными на развитие небольших производств, нежели крупномасштабных.
Одной из основных проблем водородной энергетики, помимо оптимизации технологии его получения и конечной стоимости водорода, является также его хранение и транспортировка от крупномасштабных производств к потребителям. В США и ЕС функционирует сеть трубопроводов. Такие трубопроводы, как привило, объединяют небольшое число крупных заводов со всеми потребителями водорода. Длина их, обычно, составляет несколько сотен километров. Также водород в больших количествах может быть доставлен к потребителям с помощью грузового автотранспорта. Таким образом перемещают жидкий водород, однако сам он является достаточно дорогим продуктом, так как на его производство затрачивается много энергии и средств. Газообразный же водород транспортируют только в небольших количествах. Даже при высоком давлении его плотность будет столь низка, что его вес будет составлять только 2 % от всего транспортного средства, при этом стоимость транспортировки резко повышается [8].
Биологические методы получения водорода по сей день находятся на стадии экспериментальных разработок. Однако многие эксперты в мире отмечают, что их развитие носит первостепенный характер в отрасли биотопливной энергетики [1, 2, 7]. Это можно объяснить стремлением в условиях сокращения запасов традиционных источников энергии обеспечить как можно больше отдаленных сельских местностей малыми газогенераторными биоустановоками, работающими на органических отходах. Образующийся биоводород, являющийся одним из основных продуктов процесса микробной конверсии, может быть в дальнейшем использован в качестве перспективного топлива. Также следует отметить, что водород хорошо зарекомендовал себя не только в качестве топлива для двигателей внутреннего сгорания, но и в качестве составной части ракетного топлива и необходимого компонента всех химических процессов, связанных с гидрированием [4]. Главным преимуществом биологических методов получения водорода над химическими и электрохимическими является то, что процессы катализируется микроорганизмами при относительно невысоких температурах и атмосферном давлении в окружающей среде. Кроме того, микроорганизмы могут восстановить и сконцентрировать энергию из таких водных органических ресурсов, как промышленные сточные воды [9, 16]. Как было упомянуто выше, биологические методы хорошо подходят для развития децентрализованного производства энергии в небольших установках в местах, где доступны биомасса и различные типы отходов, что способствует снижению затрат энергии и стоимости оборудования для транспортировки.
На данный момент предложены и разработаны разные виды биологических способов получения водорода, которые условно можно разделить на две группы:
- способы, для осуществления которых необходимо присутствие света;
- способы, осуществление которых не зависит от освещения.
По механизму образования водорода можно выделить следующие процессы:
- биофотолиз воды зелёными микроводорослями (прямой) и цианобактериями (непрямой);
- фоторазложение органических веществ фотосинтезирующими бактериями;
- темновая ферментация органических веществ анаэробными бактериями (брожение);
- гибридные системы, в которых используются фотосинтетические и анаэробные бактерии. [3, 4, 8]
Рассмотрим более подробно каждый из механизмов образования биоводорода и разработанные на их основе технологии его получения.
Биофотолиз воды является очень привлекательным процессом для получения водорода. Зелёные водоросли и цианобактерии могут выделять молекулярный водород в фотосинтетических реакциях, используя такие практически неистощимые и возобновляемые природные ресурсы как воду, являющейся источником электронов, и солнечный свет в качестве источника энергии [10]. Прямой фотолиз воды – её разложение на водород и кислород с помощью световой энергии – осуществляют зелёные микроводоросли по реакции [17]:
2Н2О + hv = 2H2 + O2.
Образование водорода зелёными водорослями сопряжено с осуществлением ими оксигенного фотосинтеза, который может быть охарактеризован двумя фазами. Первая фаза протекает на свету. Результат световой реакции – трансмембранный градиент протонов и выделение кислорода. Для протекания световой фазы действуют две фотосинтетические системы: фотосистема I (ФС I) и фотосистема II (ФС II). Квант света поглощается пигментами в клетках фотосинтезирующих микроорганизмов в ФС I или в ФС II или сразу в обеих системах. Это вызывает расщепление воды на кислород, протоны и электроны. Электроны через ФС I передаются ферродоксину. Ферредоксин является железосодержащим белком, выполняющим функцию переносчика электронов к ферменту гидрогеназе. Вторая фаза – темновая, в которой гидрогеназа катализирует образование водорода. Суть прямого биофотолиза заключается в том, что кислород и водород образуются одновременно, но в разных фотосистемах: в ФС II и ФС I соответственно. Существенным недостатком данного процесса является высокая чувствительность гидрогеназ к кислороду, который через 2-3 минуты их инактивирует [3, 10]. Таким образом, синтез водорода водорослями возможен только в анаэробных условиях, что предъявляет требования к организации самого процесса получения. В данном случае клетки водорослей необходимо помещать в атмосферу инертного газа, например аргона, или в атмосферу молекулярного азота, также предлагают проводить процесс под частичным вакуумом [10]. К тому же, следует непрерывно удалять выделяющийся в процессе фотосинтеза кислород.
В исследовательской практике для изучения процессов биофотолиза воды широко используют хорошо изученную одноклеточную водоросль Сhlamydomonas reinhardtii [4]. Активно ведутся работы в направлении увеличения гидрогеназной активности. Например, авторам исследования [18] удалось достичь непрерывного выделения водорода путём исключения серы из среды выращивания данных водорослей, что способствовало обратимой инактивации стадии выделения в процессе фотосинтеза кислорода. Увеличить гидрогеназную активность также можно путём получения мутантов зелёных водорослей. Был получен мутант С. reinhardtii, гидрогеназа которого на 330 % менее чувствительна к кислороду. Что касается насчёт организации процесса, то опубликовано немалое количество статей, в которых предлагают проводить иммобилизацию клеток водорослей с целью увеличения скорости накопления кислорода. Например, в работе [19] клетки С. reinhardtii иммобилизуют в гель альгината кальция, при этом максимальная скорость накопления водорода увеличивается в 1,5 раза. Гирогеназной активностью также обладают клетки таких водорослей, как Scenedesmus obliquus, Chlorococcum littorale, Chlorella fusca [4]. Однако следует отметить, что, несмотря на различные способы улучшения технологии получения водорода путём прямого биофотолиза, скорость его образования не превышает 2-3 мл/л·ч.
Непрямой биофотолиз представляет собой совокупность двух реакций, осуществляемых цианобактериями, у которых водород выделяется за счёт наличия гидрогеназы и нитрогеназы [20]:
6СО2 + 12Н2О + hv = С6Н12О6 + 6O2;
С6Н12О6 + Н2О + hv = 12H2 + 6CO2.
В этом процессе стадии выделения кислорода и водорода разделены в пространстве и во времени. На первом этапе углекислый газ в процессе фотосинтеза трансформируется в углеводы. Второй этап является сочетанием темнового брожения и фото-ферментации. При темновом брожении происходит превращение углеводов в уксусную кислоту и диоксид углерода в анаэробных условиях в темноте. Далее уксусная кислота полностью разлагается на водород и углекислый газ в анаэробных условиях фотоброжением. Нитрогеназа катализирует реакцию ассимиляции молекулярного азота из воздуха; азот восстанавливается до аммиачной формы, при этом образуется водород:
N2 + 6e— + 6H+ + 16ATP = 2NH4+ + 16ADP + 16Pi + H2
Нитрогеназа также является ферментом, чувствительным к кислороду. У цианобактерий она преимущественно локализирована в специализированных клетках, гетероцистах, не имеющих ФС II, что делает их неспособными к выделению кислорода. Кислород же выделяется остальными (вегетативными) клетками. Благодаря толстой оболочке гетероцистов, не пропускающей кислород, нитрогеназа не подвергается ингибированию им. Гидрогеназы же цианобактерий обладают способностью обратимо катализировать окисление водорода. Существуют среди цианобактерий виды, имеющие только гидрогеназу, и те, что обладают как нитрогеназной, так и гирогеназной активностью. Последние представляют наибольший интерес, так как именно они содержат гетероцисты, защищающие фермент (нитрогеназу) от ингибирующего действия кислорода. В связи с чем, многие работы посвящены изучению выделения водорода с помощью нитрогеназы у гетероцистных цианобактерий. К ним относятся такие виды, как Аnabaena variabilis, Сalothrix sp., Oscillatoria sp..
Таким образом, цианобактерии являются единственными организмами, которые могут выделять водород в воздушной атмосфере в присутствии кислорода. Скорость образования ими водорода в несколько раз выше, чем у зелёных микроводорослей, и составляет 10-40 мл/л·ч [4, 10]. Использование цианобактерий для получения водорода является предпочтительным также по той причине, что они характеризуются минимальными требованиями к субстрату. Но вода у гетероцистных цианобактерий вовлекается для образования водорода через серию промежуточных реакций, а не напрямую, как у микроводорослей и цианобактерий без гетероцист.
Прямой и непрямой биофотолиз имеет всё же ряд недостатков, ограничивающих применение зелёных микроводорослей и цианобактерий для разработки технологии получения водорода. В первом случае это связано с необходимостью использовать освещение высокой интенсивности, с низкой фотохимической эффективностью процесса (не более 5 %), а также с ингибирующим воздействием кислорода на гидрогеназу в клетках. В случае с цианобактериями также нельзя достичь приемлемой эффективности процесса. К тому же, цианобактрии, как правило, являются источниками токсинов, накапливающихся в среде культивирования, что делает получение водорода с их использованием экологически не безопасным. [20]
Способность к фоторазложению органических веществ фотосинтезирующими бактериями также рассматривают для разработки технологии получения водорода. Процесс протекает в строго анаэробных условиях. Его осуществляют пурпурные несерные бактерии с помощью нитрогеназы в условиях недостатка любых форм азота с использованием световой энергии и широкого спектра неорганических кислот [4, 8, 20]. Вот один из примеров возможной реакции:
СН3СООН + 2Н2О + hv = 4Н2 + 2СО2.
Пурпурные бактерии обладают только одной фотосистемой, похожей на ФС II, однако она не является достаточно мощной для расщепления молекул воды. Поэтому данные микроорганизмы не выделяют кислород, т. е. они осуществляют аноксигенный фотосинтез, что автоматически решает проблему ингибирования нитрогеназы кислородом [8, 20]. В результате поглощения в реакционном центре фотосистемы пигментом P 870 кванта света происходит перенос электронов через серию электронных переносчиков: хинонов и цитохромного комплекса. Электроны высвобождаются в процессе окисления органических кислот в цикле лимонной кислоты до углекислого газа. Параллельно при электронном переносе на мембранах создаётся градиент протонов, который использует АТФ-синтаза для образования АТФ. Далее электроны переносятся с АТФ через ферредоксин на нитрогеназу, которая в отсутствии азота способна восстанавливать протоны до водорода за счёт энергии АТФ. В исследовательской практике часто используют штаммы пурпурных несерных бактерий вида Rhodobacter sphaeriodes. Авторы статьи [21] показали, что клетки данного вида способны синтезировать водород из малата натрия со скоростью 10 мл/л·ч. В случае иммобилизации клеток данных бактерий на пористом стекле, продукция водорода может увеличиться до 1,1 л/л матрцы·ч.
Исследователи предпринимают попытки по комбинированию процессов фоторазложения органических субстратов и биофотолизом воды с целью получения водорода. Например, в статье [22] авторы предлагают использовать систему, в которой функционируют клетки цианобактерий Spirulina platensis и фотосинтетических бактерий Rhodobacter sphaeriodes. Цианобактрии на свету в азотодефицитной среде накапливают гликоген, который в темноте разлагается на органические кислоты с образованием водорода. Образовавшиеся органические кислоты подвергаются разложению фотосинтетическими бактериями на свету до водорода и углекислого газа. В результате, как на стадии непрямого биофотолиза воды, так и на стадии фоторазложения органических веществ скорость накопления водорода была одинаковой и составляла 18 мл/л·ч. Подобным же образом работает система, описанная в работе [23]. Сначала проводят культивирование клеток зелёных микроводорослей Сhlamydomonas sp. на свету. Накопившийся в среде крахмал в анаэробных условиях в темноте метаболизируется в несколько продуктов: уксусную кислоту, этанол, глицерин и водород. Далее культуральную жидкость отделяют от клеток микроводорослей микрофильтрацией и добавляют в нее клетки фотосинтетических бактерий Rhodobacter shpaeriodes, синтезирующих водород на свету. Концентрат микроводорослей возвращают на стадию культивирования. В данной системе водород на первой стадии накапливается со скоростью 2 мл/л·ч, во второй – 12 мл/л·ч.
Использование фоторазложения органических веществ фотосинтетическими бактериями имеет ряд преимуществ в сравнении с биофотолизом воды. Во-первых, процесс характеризуется высокой степенью конверсии субстрата в водород. Во-вторых, клетки фотосинтетических бактерий могут эффективно использовать широкий спектр органических веществ в процессе синтеза водорода. Но следует отметить, что применение таких клеток имеет недостатки: наличие у нитрогеназы чувствительности к кислороду и низкая эффективность конверсии световой энергии (не более 5 %). [20, 24]
Также известен способ получения водорода, основанный на способности пурпурных несерных бактерий осуществлять шифт-реакцию – конверсию угарного газа в водород и углекислый газ в темноте [10]:
СО + Н2О = Н2 + СО2.
Данная реакция, в отличие от подобной ей химической реакции, осуществляющей в несколько стадий и при высоких температурах, происходит в одну стадию и при комнатной температуре, что является преимуществом. Синтез водорода катализируют одновременно два фермента: гидрогеназа и специфическая СО-гидрогеназа. Скорости выделения водорода различными штаммами пурпурных бактерий в данном процессе высокие, в сравнении с выше рассмотренными способами, и варьируются в диапазоне от 140 до 700 мл/л·ч. Однако существуют проблемы, ограничивающие использование шифт-реакции для получения водорода. Одной из них является токсичность угарного газа. На данный момент для получения угарного газа предполагают использовать термальную газификацию биомассы.
Особый интерес для получения водорода представляет использование темновой ферментации [1, 4, 7, 8, 10]. Давно известно, что многие бактерии выделяют водород в результате брожения при росте в анаэробных условиях на различных углеродсодержащих субстратах. Синтез водорода катализирует гидрогеназа. Скорость образования водорода бактериями, осуществляющими брожение, во много раз превышает таковую при использовании зелёных микроводорослей и цианобактерий и может достигать до 400 мл/л·ч. Однако эффективность преобразования энергии, заключенной в используемом органическом веществе, в водород, невысокая (20-30 %). Связано это с тем, что помимо него при сбраживании органических веществ образуются и другие метаболиты: органические кислоты (уксусная, молочная и др.) и спирты (этанол, бутанол). Среди бактерий, осуществляющих темновую ферментацию в анаэробных условиях, выделяют факультативные и облигатные анаэробы. Представителями факультативных анаэробов являются такие энтеробактерии, как Еscherichia coli, Salmonella sp, Enterobacter aerogenes. К аблигатным анаэробам относят широко известные бактерии рода Сlostridium, в частности C. paraputrificum, C. lentocellum, C. thermosuccinogenes, C. bifermentans, C. thermolacticum, C. acetobutylicum, C. pasteurianum [4]. Для большинства анаэробных водородпродуцирующих бактерий характерно сбраживание сахаров с образованием единственного продукта – уксусной кислоты, т. е. гомоацетатное брожение. Из одной молекулы сбраживаемой гексозы синтезируется три молекулы ацетата. Катаболизм глюкозы начинается с её превращения в пируват и АТФ. Электроны с ферредоксина далее могут переноситься на NАD+ или на Н+, что приводит в последнем случае к образованию водорода [25].
Как отмечалось ранее, наряду с получением водорода использование процесса темнового брожения позволяет решить проблему утилизации органических отходов. Большинство исследований в данной области посвящено скринингу микробных сообществ, способных расти на дешёвых органических средах с высокими показателями по продукции водорода. Основу питательных сред могут составлять различные бытовые и сельскохозяйственные отходы. В зависимости от состава питательной среды скорость накопления водорода может варьировать в диапазоне от 90 до 600 мл/л·ч [4]. Этому оптимизация состава питательной среды также является важной частью исследований для разработки технологии получения водорода на основе анаэробного брожения. Одним из наиболее изученных и широко распространённых видов среди анаэробных бактерий рода Сlostridium является вид C. аcetobutylicum. Они способны осуществлять ферментацию углеводов, накапливая наряду с водородом органические кислоты (уксусную и масляную) и растворители (этанол, бутанол, ацетон). Общее уравнение, характеризующее процесс брожения, осуществляемый данными бактериями в среде с глюкозой, выглядит следующим образом:
5C6H12O6 + 2H2O = 2CH3COOH + CH3COCH3 + CH3(CH2)2COOH + CH3(CH2)2CH2OH + 2CH2CH2OH + 11CO2 + 10H2.
Согласно уравнению, из одного моль глюкозы можно получить 2 моль водорода, однако на практике его выход, а также выход и других продуктов метаболизма, существенно ниже. Это связано с тем, что клетки C. аcetobutylicum очень чувствительны к условиям культивироания: составу среды, рН среды, температуре, длительности культивирования, объёму реактора, соотношению объёмов газовой и жидкой фазы в реакторе. Процесс ферментации данными бактериями происходит в две стадии. На первой фазе происходит активный рост биомассы клеток и накопление в среде уксусной и масляной кислот, образование которых сопровождается выделением водорода и быстрым снинжением рН среды с 6,5 до 5,0. Это влечёт за собой переключение на вторую фазу ферментации: рост клеток замедляется, скорость накопления водорода снижается, и начинается интенсивное образование нейтральных продуктов (этанола, бутанола, ацетона), предупреждающих дальнейшее подкисление среды, неблагоприятное для бактерий [26]. Следует отметить, что образующиеся в процессе этанол и бутанол также рассматриваются как альтернативные виды биотоплива. Сырьевая база представлена широким спектром субстратов, которые могут быть использованы для процесса брожения. Получение водорода подразумевает превращение углеводов, содержащихся в сырье, в сбраживаемые сахара (сахарозу, глюкозу, арабинозу, ксилозу и др.), являющиеся необходимым субстратом для брожения. В зависимости химической структуры углеводсодержащее сырьё подразделяют на три группы:
- содержащее простые сахара (моносахариды, дисахариды);
- крахмалосодержащее;
- целлюлзосодержащее.
В работе [27] было изучено образование водорода клетками Сlostridium saccharoperbutylacetonicum в процессе сбраживания ими различных моносахаридов и дисахаридов. Было установлено, что наибольшая скорость накопления водорода при длительности процесса ферментации 20-21 ч наблюдалась при использовании глюкозы (164,6 мл/л·ч) и сахарозы (196 мл/л·ч), причём глюкоза в качестве субстрата оказалась предпочтительнее двух рассмотренных дисахаридов – мальтозы и лактозы. Стоит отметить, что концентрация субстрата, вводимого в среду, так же влияет на выход водорода. В той же работе авторы изучили влияние концентрации глюкозы в интервале от 10-60 г/л на выход водорода в процессе анаэробного брожения выше названными бактериями. Было показано, что наибольшее накопление целевого продукта (175,3 мл/л·ч) было достигнуто при концентрации субстрата в среде 40 г/л. Влияние источников азота на скорость образования азота было изучено авторами работы [28]. Наиболее перспективным в этом отношении оказалось использование дрожжевого экстракта, а также кукурузного экстракта и триптона. Клетки рода бактерий Сlostridium лучше усваивают азот, вводимый в среду в виде аминокислот и белков.
В исследованиях, посвященных получению биоводорода, всё чаще рассматривают использование в качестве исходного сырья органических отходов, количество которых неизбежно растёт с каждым годом. К тому же, применение в качестве исходных субстратов простых сахаров и крахмала удорожает конечную стоимость целевого продукта. Различные отходы, которые могут быть использованы, приведены в таблице 1 [4, 8].
Таблица 1 – Органические отходы, которые могут быть использованы для получения водорода
| Сахаросодержащие | Крахмалосодержащие | Лигноцеллюлозное |
| меласса | Картофельные очистки, отходы переработки маниока, отработанные ячменные зерна. | Жом сахарной свеклы, жом подсолнечника, солома (кукурузная, пшеничная), стержни кукурузных початков, жмых, ячменные отруби, послеспиртовая барда, отходы целлюлозно-бумажной промышленности, пивная дробина |
| Пшеничные отруби, рисовые отруби | ||
Интересно применение крахмалосодержащих отходов в составе питательных сред для культивирования клеток рода Сlostridium. Авторы работы [29] использовали в качестве углеводсодержащего субстрата для анаэробного сбраживания клетками Сlostridium buturicum остатки, получаемые после экстракции крахмала из сладкого картофеля. Такой остаток содержит около 50 % крахмала. Скорость выделения водорода клетками в реакторе с перемешиванием при постоянном рН среды 5,25 составила 150 мл/л·ч. Наряду с глюкозо- и крахмалсодержащими средами огромный интерес представляет собой использование целлюлозосодержащих отходов [1, 4, 7, 8]. Целлюлоза является основным компонентом растительной биомассы и доступна в больших количествах в виде отходов сельского хозяйства и целлюлозно-бумажной промышленности. Однако использование сред на её основе не отличается высокой эффективностью и является затруднительным из-за наличия в ней лигниновой фракции, не разлагаемой бактериями рода Сlostridium, а также иногда эфирных масел, известных своими антибактериальными свойствами.
Среди данных бактерий наиболее эффективно разлагает целлюлозу термофильный вид Сlostridium thermocellum. Суммарная скорость накопления водорода и углекислого газа при использовании этих клеток в среде с альфа-целлюлозой в концентрации 4 г/л в 5л-реакторе достигала 56,6 мл/л·ч [4]. Следует отметить, что процесс ферментации целлюлозосодержащих сред отличается большой длительностью, составляющей в среднем 160 ч. Решение проблемы эффективного использования целлюлозосодержащего сырья исследователи ведут в двух направлениях: скрининг целлюлозосодержащих термофильных водород-продуцирующих микробных сообществ, способных эффективно разлагать такое сырье в анаэробных условиях; подбор метода и условий предобработки сырья с целью увеличения доступности сбраживаемого субстрата для микроорганизмов-продуцентов водорода.
В исследовании [1] был проведён скрининг 61 водород-продуцирующих целлюлозолитических микробных сообществ, отобранных из различных экологических ниш, по температуре культивирования и целлюлозолитической активности. Анализ состава наиболее активных сообществ, два из которых представляют симбионтную микробиту пищеварительного тракта жвачных животных, был проведён с помощью денатурирующего градиентного гель-электрофореза с последующим секвенированием наиболее выделяющихся групп микроорганизмов. В результате было установлено, что в отобранных сообществах значительную долю занимает род бактерий Thermoanaerobacterium, что оказалось неожиданным для самих исследователей. Также, помимо указанного рода, в консорциумах значительное место занимают Clostridium sp., Caldanaerovigra sp., Ferridicola sp.. Что же касается технологий предобработки лигноцеллюлозного сырья, то они до сих пор находятся на стадии разработок. Среди используемых в настоящее время способов предобработки два представляют наибольший интерес [8, 7]:
- щелочной гидролиз разбавленным раствором NaOH, преимуществом которого является получение дорогостоящего чистого лигнина, с последующим ферментативным гидролизом с использованием препаратов целлюлаз отделённого от лигнина остатка;
- кислотный гидролиз разбавленным раствором H2SO4, приводящий к получению лигнина в смеси с другими трудносбраживаемыми остатками, с последующим ферментативным гидролизом с использованием препаратов целлюлаз и отделением фильтрованием полученного сбраживаемого субстрата от твёрдого остатка.
Оба метода широко применяют на практике. Перед их осуществлением сырьё необходимо предварительно измельчить. Следует подчеркнуть, что в крупномасштабном производстве неизбежна проблема, связанная с утилизацией сульфатных солей (гипса – в случае добавления мела для нейтрализации кислоты перед процессом ферментации).
Также получение водорода можно сочетать с процессом очистки сточных вод, содержащих большое количество органических веществ. Однако, в результате брожения органических загрязнений, присутствующих в стоках, образуется биогаз, большую часть которого составляет метан, синтезирующийся метанообразующими архебактериями через стадию образования водорода. Поэтому эффективность сбраживания органических веществ сточных вод в водород очень низка. Водород в рассматриваемом случае образуется на стадии ацитогенного брожения. Ацетогенные бактерии, например, Methanobacillus omelianskii, в процессе метаногенеза расщепляют спирты и жирные кислоты на уксусную кислоту, водород и углекислый газ [9]:
С2Н5ОН + Н2О = СН3СОО— + Н+ + 2Н2;
СН3СН2СОО— + 3Н2О = СН3СОО— + НСО3— + Н+ + 3Н2.
Далее мере развития биохимического процесса образовавшиеся СО2 и водород взаимодействуют с другими промежуточными соединениями с выделением метана, выход которого становится превалирующим. В процессе метанообразования бактерии используют ограниченное количество субстратов, среди которых одним из самых важных является ацетат (до 75 %). Вот некоторые примеры протекающих реакций [9]:
СO2 + 4H2 = CH4 + 2H2O;
4 HCOO— + 4H+ = CH4 + 2H2O + 3CO2;
4CO + 2H2O = CH4 + 3CO2.
Теоретически процесс метаногенеза можно затормозить и перевести его на образование водорода [9]. Этого можно достичь подбором условий, снижающих ферментативную активность метанобразующих бактерий. Например, в работе [9] авторы установили, что некоторые соединения изопренового класса, такие как гипсозид и спиростан, могут ингибировать метаногенный процесс, направляя его в сторону водородного брожения в процессе анаэробного сбраживания послеспиртовой барды. В присутствии добавок в количестве 5·10-3 масс.% накопление водорода в течение первых 10 суток достигает значений 67,8 % и 40,2 % от состава биогаза при использовании гипсозида и спиростана соответственно. Биологически активные добавки изопренового класса селективно снижают активность дегидрогеназы, тем самым ингибируя образование метаногенными микроорганизмами метана. Это способствует избирательному переключению процесса ферментации на шифт-реакцию, в которой первоначально образующийся СО взаимодействует с молекулами воды по схеме: СО + Н2О = Н2 + СО2, – а также и на другие реакции, в результате которых выделяется водород.
В данных условиях водород не используется метаногенами и выделяется в свободном молекулярном виде в повышенных количествах. Кроме того, при таких условиях повышается гидрогеназная активность микроорганизмов, ответственных за реакции образования водорода, что повышает общую эффективность процесса по синтезу водорода. Отмечается, что только 20 % энергии биомассы затрачивается на синтез водорода, остальное его количество выделяется за счёт приведённой выше шифт-реакции, поэтому до 80 % биомассы в этом процессе не участвует. В связи с этим, авторы [9] предлагают проводить анаэробную конверсию барды в две стадии. На первой стадии проводят процесс получения водорода в отдельном биореакторе в присутствии указанных биодобавок. Для более полного использования энергии биомассы на второй стадии, проводимой в следующем биореакторе, процесс необходимо осуществлять без биодобавок, тем самым индуцируя метаногенез. Таким образом, эффективность процесса переработки отхода повышается. Кроме того, в целом процессе удаётся получить совместно два альтернативных источника энергии, водород и метан.
По сравнению с фоторазложением органических веществ и биофотолизом воды темновая ферментация углеводов является более предпочтительным способом получения водорода, так как в данном случае не требуется освещение и процесс может протекать непрерывно, в течение более длительного времени. Кроме того, образующиеся в результате промежуточные метаболиты, например, уксусная кислота, являются ценными продуктами, находящими широкое применение в промышленности. Для осуществления процесса могут быть использованы различные субстраты, такие как отходы сельского хозяйства и пищевой промышленности, а также сточные воды. Однако у данного способа имеются и недостатки. Во-первых, с повышением парциального давления водорода скорость его накопления уменьшается и происходит сдвиг в сторону образования промежуточных продуктов, например, молочной кислоты, этилового спирта, ацетона, бутанола. Другим существенным недостатком анаэробной ферментации субстратов различного состава является образование водорода в смеси с углекислым газом, вследствие чего необходимо удаление последнего. Однако существует ряд разработанных мембранно-пористых систем, позволяющих разделить полученную газовую смесь [20, 24].
Ещё одной разновидностью среди биологических способов получения водорода является использование гибридных систем на основе клеток анаэробных и фотосинтетичесикх бактерий [4, 8, 20]. Как отмечалось выше, многие анаэробные водород-продуцирующие бактерии сбраживают сахара с образованием единственного продукта – уксусной кислоты. Клетки же фотосинтетических бактерий могут эффективно её использовать, разлагая на свету на водород и углекислый газ в анаэробных условиях. Биохимический процесс может быть описан в данном случае двумя реакциями:
С6Н2О6 + 2Н2О = 2СН3СООН + 2СО2 + 4Н2; анаэробные бактерии
2СН3СООН + 8Н2О + hv = 8Н2 + 4СО2 фотосинтетические бактерии.
Например, авторы работы [30] показали, что совместное использование клеток анаэробных бактерий C. pasteurianum и фотосинтетических бактерий Rhodobacter sphaeriodes позволяет получать целевой продукт стабильно в течение 10 суток со скоростью 25,9 мл/л·ч. При разработке гибридных систем для получения водорода необходимо учитывать, в каком соотношении вносить клетки двух типов культур в реакционную среду. По результатам проведённых исследований [31], оптимальным соотношением фотосинтетических и анаэробных бактерий является 5,9:1.
Автор исследования [4] предлагает использовать гибридную систему получения водорода: замкнутую биокаталитическую систему получения водорода биофотолизом воды, на основе двухстадийного процесса с применением клеток зелёных кислород-продуцирующих микроводорослей и водород-продуцирующих анаэробных бактерий, полный рабочий цикл которой может быть осуществлен многократно. В данном разработанном способе сопряжены процессы накопления биомассы клеток Chlorella vulgaris и её анаэробной конверсии бактериями Clostridium acetobutylicum. Биомасса большинства микроводорослей отличается высоким содержанием углеводов (выше 40%), что позволяет использовать её в качестве единственного источника углерода для анаэробного сбраживания. Зелёные микроводоросли Chlorella vulgaris являются наиболее перспективным субстратом для осуществления анаэробной ферментации с точки зрения выходов водорода и условий его накопления. Составы сред, требуемых для культивирования данных микроводорослей, характеризуются минимальным содержанием солей, что отбрасывает необходимость весьма дорогостоящего оборудования, устойчивого к коррозии. Кроме того, биомасса водорослей может служить дополнительным источником органического азота. На первом этапе проводят накопление биомассы клеток C. vulgaris в непрерывном режима культивирования в экспериментальном лабораторном фотобиореакторе (ООО «АСПЕКТ», Россия).
Суспензию клеток микроводорослей помещают в реактор объемом 20 л, из которого посредством центробежного насоса её прокачивают со скоростью 20 л/мин через систему стеклянных трубок с внутренним диаметром 35 мм и внешним диаметром 38 мм. Среда барботируется углекислым газом со скоростью 1 – 2 мл/мин. Также в системе поддерживают постоянное освещение мощностью 5000 Люкс источниками света с длиной волны в интервалах 450 – 480 нм и 640 – 700 нм одновременно с целью максимального использования его энергии.
Регулярно производится замена 4 л суспензии клеток на 4 л свежей среды. Фотобиореактор полностью оснащён автоматизированной системой контроля различных параметров культивирования. Таким образом, была показана возможность эффективного накопления и поддержания культуры клеток C. vulgaris в концентрации 8 – 10 г/л в течение не менее 50 суток культивирования в автоматизированной системе используемого фотобиореактора. Далее для увеличения доступности при последующем сбраживании предварительно сконцентрированную биомассу микроводорослей подвергают предобработке путем термолиза при 108 °C и избыточном давлении 0,5 атм в течение 30 мин. На следующем этапе проводят процесс анаэробной ферментации. Водную суспензию термообработанных микроводорослей вносят в мини-реактор (5 л) в концентрации 20 – 30 г СВ/л. Также вносят иммобилизованные в криогель поливинилового спирта клетки C. acetobutylicum в концентрации 15 г/л в среде. Процесс осуществляют в анаэробных условиях в атмосфере аргона при 37 °C в течение 96 ч. Многократное использование иммобилизованного катализатора на основе клеток C. acetobuylicum при конверсии биомассы клеток C. vulgaris обеспечивает накопление водорода без индукционного периода со скоростью 58,2 мл/л·ч.
Принципиальная схема получения водорода биофотолизом воды с использованием биомассы клеток микроводорослей C. vulgaris и бактерий C. acetobutylicum представлена на рис.1.
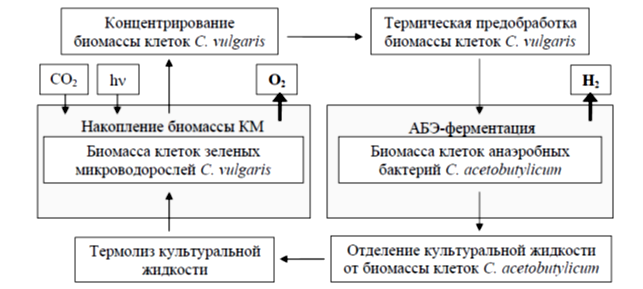
Рис. 1. – Принципиальная схема получения водорода биофотолизом воды с ипользованием биомассы клеток микроводорослей C. vulgaris и бактерий C. acetobutylicum
Полный рабочий цикл предлагаемого комбинированного способа может быть осуществлен непрерывно не менее 5 раз без замены используемых иммобилизованных в криогель поливинилового спирта клеток анаэробных бактерий.
На данный момент использование гибридных систем для получения водорода не реализовано на практике, так как их создание сопряжено со сложностью реакторов, в организации процесса в целом, а также с существенными физиологическими различиями между клетками анаэробных и фотосинтетических бактерий, что накладывает дополнительные трудности для оптимизации процесса и конструкций биореакторов. Однако исследователи в данном направлении продолжают активно работать. [20].
Отдельную проблему в биологических способах получения водорода представляет собой его отделение из получаемой газовой смеси и очистка. В работе [8] был разработан и интегрирован в ферментационную систему мембранный модуль с целью непрерывного отвода газообразного водорода из культуральной жидкости. Для конструирования мембранного блока сепарации, работающего на границе раздела двух фаз (газа и жидкости), была использована полимерная мембрана на основе поливинилтриметилсилановые (ПВТМС). Полимерная асимметричная мембрана ПВТМС была выбрана в силу своей высокой газопроницаемости по исследуемым газам (H2 и CO2) и физико-химической стабильности. Она не подвергается механическому засорению сторонними агентами, устойчива к обрастанию микроорганизмами и сохраняет свои свойства при относительно высоких (60-70 °C) температурах. Модуль, через мембрану которого непосредственно контактирует со средой культивирования с помощью мембранных контактов. При использовании традиционной технологии сдувки водорода инертными газами, аргоном или азотом, происходит разбавление газовой смеси. Предложенная же технология, главным образом, позволяет облегчить дальнейшую очистку получаемой газовой смеси.
В таблице 2 приведены по данным [8, 32] мощности для различных технологий производства водорода, в том числе комбинированных.
Таблица 2 – Сравнение производственных мощностей получения водорода
| Технология | Мощность, млн. м3/день | ||||
| 0,01-0,03 | 0,03-0,1 | 0,1-0,3 | 0,3-1 | 1-3 | |
| Газификация биомассы | |||||
| Пиролиз нефти | |||||
| Суперкритичная газификация воды | |||||
| Анаэробное сбраживание | |||||
| Темновая ферментация + метаногенез | |||||
| Темновая ферментация + фотоферментация | |||||
| Фотоферментация | |||||
| Прямой биофотолиз | |||||
| Непрямой биофотолиз | |||||
Как видно из приведённых данных, термохимические способы получения пригодны для организации крупномасштабного производства водорода, в то время как биохимические технологии предпочтительно применять для небольших производств, за исключением прямого и непрямого биофотолиза. Некоторые исследователи считают перспективным внедрение биофотолиза на предприятиях большой мощности, однако процесс отработан только на лабораторных установках. Если говорить о себестоимости процесса получения водорода, то при получении его с помощью термохимических способов она варьируется в диапазоне 2,5-5 $ килограмм, для электролиза – 7-10. Среди биологических способов получения одним из самых дорогих по оценкам экспертов является биофотолиз: себестоимость процесса за килограмм водорода может составить 10-15 $. Цена же водорода, полученного анаэробным сбраживанием, может быть соизмерима с ценой топлив нефтяного происхождения, и даже ниже в зависимости от материально-сырьевого обеспечения технологии.
Основную часть исследований составляет также разработка аппаратурного оформления для систем получения водорода, в частности, конструирование биореакторов. Существующие на данный момент фотобиореакторы, предназначенные для культивирования цианобактерий и зелёных микроводорослей, являются пилотными установками небольшого (до 50 л) объёма. Например, для культивирования цианобактерий широко используют трубчатый фотобиореактор. Основу его конструкции составляет прозрачная поливинилхлоридная трубка длиной 42 м и диаметром 7,9 мм, закрученная спиралью вокруг вертикального пластикового цилиндра объёмом 2 л и высотой 0,4 м со встроенной флуоресцентной лампой [10]. Смесь воздуха и углекислого газа барботируется под избыточным давлением Известно, что на Гавайских островах построен окологоризонтальнй фотобиореактор, расположенный на поставленной под углом 10° платформе и состоящий из 20 метровых пластиковых труб диаметром 3,8 см общим объёмом до 230 л. Расположение реактора под углом позволяет более эффективно снабжать клетки углекислым газом. Для осуществления темновой анаэробной ферментации в последнее время уделяют внимание применению ферментёров со встроенными половолоконными мембранами. Бактерии находятся в иммобилизованном состоянии на внешней стороне волокон, в то время как питательная среда насосом перекачивается из внутреннего пространство волокон наружу внутрь ферментёра. Образующаяся газовая смесь водорода и углекислого газа проходит через полупроницаемую мембрану волокон, отводясь от ферментационной среды.
Согласно литературным данным, среди всех рассмотренных выше биологических процессов анаэробная ферментация органических веществ анаэробными бактериями в сочетании с фоторазложением продуктов их метаболизма фотосинтетическими бактериями представляется наиболее перспективной для получения водорода, так как в данном случае его образование происходит с наиболее высокими скоростями. К тому же, применение водород-продуцирующих бактерий, осуществляющих темновую ферментацию, позволяет использовать широкий спектр субстратов, в том числе органические отходы и углеводсодержащие среды, включая сточные воды. Это существенно повышает привлекательность производства водорода как с экономической, так и с экологической точки зрения. Многочисленные обширные исследования в области гибридных систем получения водорода направлены на повышение его выхода и скорости его накопления [13]. Основной задачей данных исследований является достижение максимальной конверсии используемого субстрата в водород. Таким образом, разработка технологии получения водорода на основе данного комбинированного биологического способа с использованием сред различного состава является одной из важнейших задач в области получения альтернативных видов топлива.
Развитие биохимической водородной энергетики связано также с необходимостью решения таких проблем, как интенсификации процесса образования водорода, оптимизации конструкций биореакторов, создания эффективных и недорогих систем очистки биоводорода, безопасных систем его хранения и распределения, а также совершенствования топливных элементов [9].
Несмотря на высокую перспективность получения водорода биологическими способами, на сегодняшний день его производство такими способами не вышло за пределы пилотных установок, так как описанные выше технологии требуют дальнейшего совершенствования. Нельзя пока утверждать, что в России биохимическая водородная энергетика находит достаточную для развития поддержку со стороны государственных структур, хотя данное направление относят к приоритетным в стране.
СПИСОК ЛИТЕРАТУРЫ
- Садраддинова, Э. Р. [и др.] Скрининг микробных сообществ–продуцентов биоводорода [Текст] / Э. Р. Садраддинова [и др.] // Вестник биотехнологии и физико-химической биологии им. ЮА Овчинникова. – 2013. – Т. 9. – №. 2. – С. 43-51.
- Василов, Р.Г. Перспективы развития производства биотоплива в России. Cообщение 3: биогаз [Текст] / Р. Г. Васильев // Вестник биотехнологии и физико-химической биологии им. Ю.А. Овчинникова. – 2007. – Т. 3. – № 3. – С. 54–61.
- Василов, Р.Г. Перспективы развития производства биотоплива в России. Cообщение 4: биоводород [Текст] / Р. Г. Васильев // Вестник биотехнологии и физико-химической биологии им. Ю.А. Овчинникова. – 2009. – Т. 5. – № 1. – С. 35–41.
- Никольская, А. Б. Каталитические системы получения водорода биофотолизом воды [Текст] : дис. … канд. хим. наук : 02.00.04, 03.01.06 / А. Б. Никольская. – Москва, 2012. – 169 с. : ил. – Библиогр. : с 130-169.
- Berndes, G., Hoogwijk, M., van den Broek R. The contribution of biomass in the future global energy supply: a review of 17 studies [Text] // Biomass and bioenergy. – 2003. – V. 25. – №. 1. – P. 1-28.
- Saxena, R. C., Adhikari, D. K., Goyal, H. B. Biomass-based energy fuel through biochemical routes: a review [Text] // Renewable and Sustainable Energy Reviews. – 2009. – V. 13. – №. 1. – P. 167-178.
- Садраддинова, Э. Р. [и др.] Влияние различных факторов на эффективность процесса термофильной микробной конверсии органических отходов в биоводород [Текст] Э. Р. Садраддинова // Вестник биотехнологии и физико-химической биологии им. Ю.А. Овчинникова. – 2013. – Т. 9. –№.2. – С. 52-62.
- Садраддинова, Э. Р. Микробная переработка целлюлозосодержащего органического сырья в водород [Текст] : дис. … канд. биол. наук : 03.02.03, 03.01.06 / Э. Р. Садраддинова. – Москва, 2010. – 115 с. : ил. – Библиогр. : с 83-115.
- Ковалев, В. В. [и др.] Изучение процессов анаэробного получения биоводорода [Текст] / В. В. Ковалёв // Сборник статей Молдавского государственного университета. – 2012. – Т. 1. – № 51. – С. 152-159.
- Марков, С. А. Биоводород: возможное использование водорослей и бактерий для получения молекулярного водорода [Текст] / C. А. Марков //Альтернативная энергетика и экология. – 2007. – Т. 1. – №. 45. – С. 30-35.
- Аншиц, А. Г., Воскресенская, Е. Н. Окислительная конденсация метана – новый процесс переработки природного газа [Текст] А. Г. Аншиц, Е. Н. Воскресенская // Соровский образовательный журнал. – 1999. – №. 9. – С. 38-43.
- Гамбург, Д. Ю. [и др.] Справочник. Водород. Свойства, получение, хранение, транспортирование, применение [Текст] / Д. Ю. Гамбург [и др.] : М., Химия, 1989. – 672 с.
- Цыганков, А. А. Получение водорода [Текст] / А. А. Цыганков // Рос. хим. ж. (Ж. Рос. хим. об-ва им. Д.И.Менделеева. – 2006. – Т. 50. – №. 6. – С. 26 33.
- Ковалев, В.В. [и др.] Совершенствование электрохимических процессов для водородной энергетики [Текст] / В. В. Ковалёв // Проблемы региональной энергетики. – 2011. – №.1. – С. 3-15.
- Padró, C. E. G., Putsche, V. Survey of the economics of hydrogen technologies [Text] : Golden, CO, National Renewable Energy Laboratory, 1999 – р. 57.
- Kirtay, E. Recent advances in production of hydrogen from biomass [Text] // Energy conversion and management. – 2011. – V. 52. – №. 4. – P. 1778-1789.
- Цыганков, А. А. Получение водорода биологическим путем [Текст] / А. А. Цыганков // Российский химический журнал. – 2006. – Т. 50. – №. 6. – С. 26-33.
- Melis, A. [et al.] Sustained photobiological hydrogen gas production upon reversible inactivation of oxygen evolution in the green AlgaChlamydomonas reinhardtii [Text] // Plant physiology. – 2000. – V. 122. – №. 1. – P. 127-136.
- Tsygankov, A.A. [et al.] H2 photoproduction by batch culture of Anabaena variabilis ATCC 29413 and its mutant PK84 in a photobioreactor [Text] // Biotechnology and bioengineering. – 1999. – V. 64(6). – P. 709-715.
- Lee, D. J., Show, K. Y., Su, A. Dark fermentation on biohydrogen production: pure culture [Text] // Bioresource technology. – 2011. – V. 102. – №. 18. – P. 8393-8402.
- Ikuta, Y., Akano, Т., Shioji, N., Maeda, I. Hydrogen production by photosynthetic microorganisms [Text] // BioHydrogen, edited by Zaborsky et al : Plenum Press, New York, 1998. – V. 40. – P. 319-328.
- Melis, A., Melnicki, M. R. Integrated biological hydrogen production [Text] // International Journal of Hydrogen Energy. – 2006. – V. 31. – №. 11. – P. 1563-1573.
- Ren, Y. [et al.] Hydrogen production from the monomeric sugars hydrolyzed from hemicellulose by Enterobacter aerogenes [Text] // Renewable Energy. – 2009. – V. 34. – №. 12. – P. 2774-2779.
- Winkler, M. [et al.] Fe-hydrogenases in green algae: photo-fermentation and hydrogen evolution under sulfur deprivation // International Journal of Hydrogen Energy. – 2002. – V. 27. – №. 11. – P. 1431-1439.
- Redwood, M. D., Paterson-Beedle, M., Macaskie, L. E. Integrating dark and light bio-hydrogen production strategies: towards the hydrogen economy [Text] // Reviews in Environmental Science and Biotechnology. – 2009. – V. 8. – №. 2. – P. 149-162.
- Chen, C. Y. [et al.] Biohydrogen production using sequential two-stage dark and photo fermentation processes [Text] // International Journal of Hydrogen Energy. – 2008. – V. 33. – №. 18. – P. 4755-4762.
- Wang, C. H., Chang, J. S. Continuous biohydrogen production from starch with granulated mixed bacterial microflora [Text] // Energy & Fuels. – 2007. – V. 22. – №. P. – С. 93-97.
- Liu G., Shen, J. Effects of culture and medium conditions on hydrogen production from starch using anaerobic bacteria [Text] //Journal of bioscience and bioengineering. – 2004. – V. 98. – №. 4. – P. 251-256.
- Cappelletti, B. M. [et al.] Fermentative production of hydrogen from cassava processing wastewater by Clostridium acetobutylicum [Text] // Renewable Energy. – 2011. – V. 36. – №. 12. – P. 3367-3372.
- Mata, T. M., Martins, A. A., Caetano N. S. Microalgae for biodiesel production and other applications: a review [Text] // Renewable and sustainable energy reviews. – 2010. – V. 14. – №. 1. – P. 217-232.
- Melis, A., Happe, T. Hydrogen production. Green algae as a source of energy [Text] // Plant physiology. – 2001. – V. 127. – №. 3. – P. 740-748.
- Claassen, P. A. M., De Vrije, T. Non-thermal production of pure hydrogen from biomass: Hyvolution [Text] // International Journal of Hydrogen Energy. – 2006. – V. 31. – №. 11. – P. 1416-1423.

